Вильямсона синтез
ВИЛЬЯМСОНА СИНТЕЗ
получение простых эфиров (обычно несимметричных) алкилированием алкоголятов или фенолятов алкилгалогенидами:
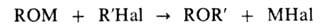
Для синтеза алифатич. эфиров смесь алкоголята с R'Hal кипятят без растворителя или в растворителе, индифферентном к реагентам (напр., в эфире, толуоле, ксилоле). Используют также спиртовые растворы KOH или алкоголятов.
Для синтеза алкилариловых эфиров кипятят смесь небольшого избытка AlkHal и фенолята в спиртовом растворе. В качестве растворителя используют также воду, ацетон, этилацетат, диоксан, толуол, ксилол, хлорбензол. Углеводы О-метилируют в жидком NH3 действием Na, затем CH31.
Растворитель часто оказывает решающее влияние на выход продуктов реакции. Например, высокий выход эфиров из орто-и пара-гидроксибифенилов достигается при проведении реакции в ацетоне; в спирте же выходы крайне низкие. Обычно выходы арилалкиловых эфиров с первичными и вторичными алкильными радикалами составляют 80–90%. Как диалкиловые, так и алкилариловые эфиры часто удобно синтезировать в условиях межфазного катализа. Для повышения скорости реакции при использовании RBr и RC1 в реакционную смесь добавляют Nal в количестве 0,1–0,2 эквивалента.
В качестве побочных продуктов в реакции образуются олефины:
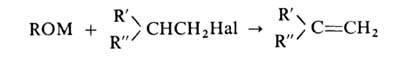
Их количество возрастает в зависимости от структуры AlkHal в ряду: первичные < вторичные < третичные. Поэтому при получении эфира, содержащего разветвленный радикал, следует выбирать такую комбинацию реагентов, чтобы разветвленный радикал входил в состав молекулы алкоголята. Для уменьшения выхода олефинов целесообразно также снижение температуры реакции и использование менее реакционноспособных алкоголятов (напр., магниевых) и алкилгалогенидов (хлоридов и бромидов вместо иодидов).
Получение алкилариловых эфиров часто сопровождается алкилированием бензольного кольца (С-алкилирование). Эта реакция особенно характерна для многоосновных фенолов, содержащих OH-группы в мета-положениях. Направление этой реакции существенным образом зависит от растворителя: в спирте, ацетоне, ДМФА, ДМСО преобладает О-алкилирование (т. е. образование простых эфиров), в водных растворах, а также в менее полярных растворителях, таких, как бензол, толуол, — С-алкилирование. Для уменьшения доли продукта С-алкилирования реакцию проводят в слабощелочной среде.
B.C. осуществляется обычно по механизму бимолекулярного нуклеоф. замещения. В случае третичных RHal преобладает мономолекулярное нуклеоф. замещение и элиминирование.
В модификациях B.C. в качестве алкилирующих агентов применяют диалкилсульфаты, что особенно удобно для алкилирования реакционноспособных спиртов (напр., бензилового, аллилового, коричного), углеводов и фенолов. Из др. алкилирующих агентов используют эфиры муравьиной кислоты, ортоэфиры и эфиры арил- и алкилсульфокислот, соли триалкилоксония. Для алкилирования гидроксикислот применяют алкилиодиды в присутствии Ag2O или BaO. Удобный метод синтеза PhOR — алкилирование фенолов в растворе ацетона в присутствии поташа (этот синтез наз. реакцией Клайзена). Реакция открыта А. Вильямсоном в 1851.
Лит.: Вебер В., ГокельГ., Межфазный катализ в органическом синтезе, пер. с англ., М., 1980, с. 97–110; Бюлер К., Пирсон Д., Органические синтезы, пер. с англ., ч. 1, М., -J973, с. 326–373; Н ouben-Wey I, Methoden der organischen Chemie, 4 Aufl, Bd 6, Tl 3, Stuttg., 1965; Wang Chin-Hsien [a.o.], "Synthesis", 1982, N 10, p. 8581.
Г. А. Артамкина
