висмут
ВИСМУТ (нем. Wismut; лат. Bismuthum) Bi
хим. элемент V гр. периодической системы; ат. н. 83, ат. м. 208,9804. В природе один стабильный изотоп 209Bi. Короткоживущие радиоактивные изотопы с мас. ч. от 210 до 215 и периодами полураспада от 2 мин до 5 сут — члены прир. радиоактивных рядов. Поперечное сечение захвата тепловых нейтронов для В. 3,4∙10−30 м2. Конфигурация внеш. электронной оболочки 6s26p3; степени окисления +3, +5 и — 3, очень редко + 1 и + 2; энергия (эВ) ионизации при по-следоват. переходе от Bi° к Br5+ : 7,289, 16,74, 25,57, 45,3 и 56,0; сродство к электрону 0,7 эВ; электроотрицательность по Полингу 1,9; атомный радиус 0,182 нм, ионные радиусы (в скобках указаны координац. числа) 0,110 нм (5), 0,117 нм (6), 0,131 нм (8) для Bi3+ , 0,090 нм (6) для В15+ , 0,213 нм для Bi3−.
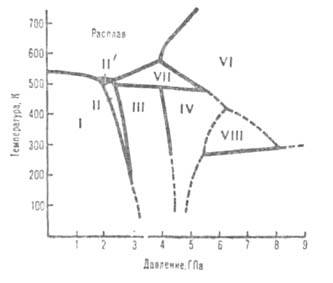
Диаграмма состояния висмута при высоких давлениях. Пунктирные линии-приблизительные границы областей существования фаз.
Содержание В. в земной коре 2∙10−5 % по массе, в морской воде — 2∙105 мг/л. Важнейшие минералы — висмутин Bi2S3, самородный Bi, козалит Pb2Bi2S5, тетрадимит Bi2Te2S, бисмит Bi2O3, бисмутин Bi2CO3 (OH)4. Собственно висмутовые руды редки. Обычно В. добывают из свинцовых, медных, оловянных, вольфрамовых и др. руд.
Свойства. В. — серебристо-серый металл с розоватым оттенком. Имеет грубозернистое строение. Может существовать в неск. кристаллич. модификациях (см. рис., табл.); при атм. давлении устойчива только модификация I, которая при 2,57 ГПа и 25 °C переходит в II, при 2,72 ГПа — в III, при 4,31 ГПа — в IV, ок. 5 ГПа — в V, при 7,74 ГПа — в VI, при 30 ГПа — в IX.
ХАРАКТЕРИСТИКА НЕКОТОРЫХ КРИСТАЛЛИЧЕСКИХ МОДИФИКАЦИЙ ВИСМУТА

Для В. т. пл. 271,4 °C (модификация I), т. кип. 1564 °C; плотн. 9,80 г/см3, жидкого 10,27 г/см3 (271 °C); C0p26,0 Дж/(моль *К); 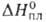 11,0 кДж/моль,
11,0 кДж/моль, 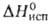 177,0 кДж/моль; S0298 56,9 Дж/(моль∙К); уравнения температурной зависимости давления пара: над твердым В. Igp(rHa) = 9,285 — 9725/T- 0,2401gT+ 1,180Т, над жидким lg р (гПа) = 7,516 — 8929/T- 0,1171g T, температурный коэф. линейного расширения 12,8∙10−6 К−1 (283 К); теплопроводность 8,41 Вт/(м∙К) при 293 К;
177,0 кДж/моль; S0298 56,9 Дж/(моль∙К); уравнения температурной зависимости давления пара: над твердым В. Igp(rHa) = 9,285 — 9725/T- 0,2401gT+ 1,180Т, над жидким lg р (гПа) = 7,516 — 8929/T- 0,1171g T, температурный коэф. линейного расширения 12,8∙10−6 К−1 (283 К); теплопроводность 8,41 Вт/(м∙К) при 293 К; 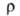 109∙10−8 Ом∙м, при температуре плавления
109∙10−8 Ом∙м, при температуре плавления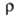 твердого В. 267∙10−8 Ом∙м, жидкого 127∙10−8 Ом∙м, температурный коэф.
твердого В. 267∙10−8 Ом∙м, жидкого 127∙10−8 Ом∙м, температурный коэф.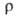 4,2∙10−3 К−1 (273 К); температура перехода в сверхпроводящее состояние ~ 7 К; стандартный электродный потенциал 0,2 В; диамагнитен, магн. восприимчивость — 1,340∙10−9. Твердость по Моосу 2,5, по Бринеллю 89 МПа;
4,2∙10−3 К−1 (273 К); температура перехода в сверхпроводящее состояние ~ 7 К; стандартный электродный потенциал 0,2 В; диамагнитен, магн. восприимчивость — 1,340∙10−9. Твердость по Моосу 2,5, по Бринеллю 89 МПа; 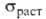 33,6 ГПа,
33,6 ГПа, 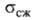 14,7 МПа. В. хрупок, но при 225–250 °C может подвергаться пластич. деформации.
14,7 МПа. В. хрупок, но при 225–250 °C может подвергаться пластич. деформации.
В сухом воздухе В. устойчив, во влажном постепенно покрывается буроватой пленкой оксидов. Заметное окисление начинается ок. 500 °C. Выше 1000 °C В. горит голубоватым пламенем с образованием Bi2O3 (см. висмута оксиды). Не реагирует с H2, С, N2, Si. Жидкий В. незначительно растворяет фосфор. При сплавлении В. с серой образуется Bi2S3, с Se и Те — соотв. селениды и теллуриды. При нагр. он взаимод. с галогенами (см. висмута галогениды). С большинством металлов при сплавлении образует интерметаллич. соед. — висмутиды, напр. Na3Bi, Mg3Bi. He реагирует с соляной кислотой и разб. H2SO4. С азотной кислотой образует нитрат, с конц. H2SO4 при нагр. — гидросульфат BiH(SO4)2. Соли В. легко гидролизуются. Осаждение гидроксисолей В. начинается при pH ~ 1,6, полное осаждение достигается при pH 4,8. Исключением являются перхлоратные растворы из-за высокой растворимости гидроксиперхлората Bi(OH)2ClO4. В структуре гидроксосолей (устар. — соли висмутала) присутствуют октаэдрич. ионы [Bi6O6]6+ , [Bi6O4(OH)4]6+ и [Bi6(он)12]6+.
Важнейшим соед. В. посвящены спец. статьи. Ниже приводятся сведения о некоторых других соед. этого элемента.
Нитрат существует в виде Bi(NO3)3*5H2O — бесцветные кристаллы с т. пл. 75 °C и плотн. 2,8 г/см3. В воде раств. инконгруэнтно с образованием осадка гидроксинитрата Bi(OH)2NO3. Устойчив в разб. растворах HNO3. Хорошо раств. в эфире и ацетоне. Гидроксииитрат — бесцветные кристаллы с перламутровым блеском; при 400–450 °C разлагается до Bi2O3; не раств. в воде, легко раств. в кислотах. Вяжущее и антисептич. средство.
Сульфат Bi2(SO4)3 — бесцветные кристаллы; образует три- и гептагидраты. Так же, как гидросульфаты и гидроксисульфаты, мало раств. в воде (не более 0,3% по массе в пересчете на Bi2O3); выше ~ 400 °C разлагается с образованием оксисульфатов.
При сплавлении Bi2O3 и SiO2 образуются ортосиликат Bi4(SiO4)3 (т. пл. 1020 °C), отвечающий по составу минералу эвлитину, и оксисиликат (силикосилленит) Bi12SiO20 (т. пл. 880 °C). Эти соед. благодаря их пьезоэлектрич. и электрооптич. свойствам применяют в радиоэлектронике. Они м. б. синтезированы также гидротермальным путем из оксидов в растворах щелочей.
Сесквиселенид Bi2Se3 и. сесквителлурид Bi2Te3 по свойствам напоминают Bi2S3 (см. висмута сульфиды). Кристаллизуются в ромбоэдрич. решетке (пространств. группа RЗm, z = 9). Для Bi2Se3 а = 0,418 нм, с = 2,87 нм; т. пл. 706 °C; плота. 7,66 г/см , уравнение температурной зависимости давления пара над твердым веществом: 1gр(гПа) = 12,347 — 11890/Т, ΔH0обр −140 кДж/моль; теплопроводность 0,025 Вт/(см∙К); ширина запрещенной зоны 0,35 эВ; коэф. термоэдс — 300 мВ/К; подвижность электронов 600см2 /(В∙с). Для Bi2Те3 а = 0,438нм, с = 3,04нм; т. пл. 586 °C; плота. 7,859 г/см3; уравнение температурной зависимости давления пара над твердым веществом: 1др(гПа) = 11,175 —10443/T; C0p 124 Дж/(моль∙К); 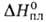 118,6 кДж/моль,
118,6 кДж/моль, 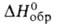 −76,8 кДж/моль; S0298 251 Дж/(моль∙К); теплопроводность 0,0175 Вт/(см∙К); ширина запрещенной зоны 0,15 эВ; коэф. термоэдс +230 мВ/К; подвижность электронов 1150 см2 /(В∙с), подвижность дырок 440 см2 /(В∙с).
−76,8 кДж/моль; S0298 251 Дж/(моль∙К); теплопроводность 0,0175 Вт/(см∙К); ширина запрещенной зоны 0,15 эВ; коэф. термоэдс +230 мВ/К; подвижность электронов 1150 см2 /(В∙с), подвижность дырок 440 см2 /(В∙с).
Получают Bi2Se3 и Bi2Te3 сплавлением элементов в кварцевом или графитовом тиглях в инертной атмосфере или под слоем флюса. Иногда сесквителлурид и его сплавы с сесквиселенидом производят горячим прессованием смеси порошков элементов с послед. отжигом. Используют их как материалы термоэлектрич. генераторов. Известны также низшие селениды и теллуриды общих формул BiЭ2 (обладают широкими областями однородности), Bi2Э и др. Все они плавятся инконгруэнтно.
Получение. Содержание В. в рудах обычно составляет десятые или сотые доли процента (только для очень немногих месторождений — неск. %). При переработке руд В. попадает в свинцовые, медные и др. концентраты. Из этих концентратов получают ок. 90% всего добываемого В.
Осн. источник В. — свинцовые концентраты, получаемые при переработке свинцовых, а также свинцово-цинковых и др. полиметаллич. руд. Они содержат неск. сотых процента В., иногда — до 0,2%. При переработке этих концентратов В. почти полностью попадает в черновой свинец, из которого удаляется при его рафинировании. Обычно выделение В. из свинца производится действием Mg и Ca, при этом В. переходит в дроссы (поверхностные слои) в виде CaMg2Bi2. Известен также способ отделения В. действием К и Mg. Иногда применяют электролитич. рафинирование, при котором В. переходит в шламы.
Дроссы для удаления Ca и Mg переплавляют под слоем щелочи с добавлением окислителя (NaNO3). Обогащенный сплав обычно подвергают электролизу в кремнефторидной ванне с получением шламов, которые далее переплавляют на черновой В. Иногда для отделения Pb применяют обработку Cl2. Предложен также электролиз в легкоплавких солевых расплавах с накоплением В. в анодном расплаве вплоть до получения чернового В.
В медных концентратах содержание В. обычно составляет неск. тысячных процента, лишь изредка — десятые доли. При их переработке В. концентрируется в пылях плавильных печей и конвертеров, откуда его извлекают восстановительной плавкой с содой и углем. Медно-висмутовые концентраты со сравнимым содержанием этих элементов перерабатывают гидрометаллургич. путем. Выщелачивание производится при ~ 105 °C соляной кислотой или H2SO4 с добавлением хлоридов металлов. В. выделяют из растворов гидролитич. осаждением (pH ~ 2,5) в виде окси- или гидроксихлоридов либо восстановлением железом в виде металла (цементация). Для отделения В. от сопутствующих металлов м. б. использованы экстракция и ионный обмен. Осадки оксихлорида переплавляют с добавлением соды и угля: 4BiOС1 + 2Na2CO3 + ЗС → 4Bi + 4NaCl + 5CO2.
Собственно висмутовые концентраты (содержат обычно не более 3–5% В. по массе, в редких случаях 30–60%) получают обогащением висмутовых руд флотацией и др. способами. Перерабатывают концентраты путем восстановительной плавки (после обжига или агломерации) либо осадительной плавки с добавлением металлич. железа. Известны содовая плавка (4Bi2S3 + 12Na2CO3 → 8Bi + 9Na2S + 3Na2SO4 + 12CO2), а также щелочная с NaOH.
Рафинирование В. заключается в последоват. обработке его расплава: серой с добавлением угля (для удаления Fe и Cu); щелочью с добавлением окислителя или продувкой воздухом (для удаления As, Sb и Sn); цинком (для удаления Au и Ag); хлором (для удаления Pb и Zn). Применяют также электролитич. рафинирование как в водных растворах [В1Cl3, Bi2(SiF6)3], так и в солевых расплавах. Для получения В. высокой чистоты используют комбинацию разл. методов.
Определение. Качественно В. обнаруживают действием на его растворы CS(NH2)2, KCNS (в обоих случаях происходит желтое окрашивание), цинхонина с KI (оранжевое), а также по ускорению восстановления солей Pb2+ станнатом Na2SnO2 (черный осадок). Количественно В. определяют: комплексонометрически в присутствии пирокатехинового фиолетового, ксиленолового оранжевого или др. индикаторов; фотометрически с применением CS(NH2)2 или его производных (напр., о-толилтиокарбамида), дитизона, динафтилтиокарбазона и их производных.
Для отделения В. от сопутствующих элементов используют гидролитич. осаждение в виде гидроксисолей. В. может быть осажден из растворов также в виде фосфата BiPO4*H2O, оксикарбоната (BiO)2CO3*0,5H2O, гидроксихромата Bi(OH)CrO4 и др. Для отделения В. используют также осаждение купфероном, тионалидом, 8-гидроксихинолином, экстракцию аминами из солянокислого раствора.
Применение. Металлич. В. — компонент легкоплавких сплавов, припоев, баббитов и др., присадка к легко обрабатываемым сталям, др. сплавам, алюминию. Сплавы В. с Mn применяют для изготовления мощных постоянных магнитов.
Мировое производство В. (без СССР) ок. 2600 т/год (1982). Осн. производители — Австралия, Япония, Боливия, Перу. В. известен с 18 в. Его хим. индивидуальность установлена в 1739 И. Потто м.
Лит.: Глембоцкий В. А., Соколов Е. С, Соложенкин П. М., Обогащение висмутсодержащих руд, Душ., 1972; Металлургия висмута, А.-А., 1973; Самсонов Г. В., Абдусалямова М. Н., Черногоренко В. Б., Висмутиды, К., 1977.
П. И. Федоров
Значения в других словарях
- висмут — -а, м. 1. Химический элемент, хрупкий серебристо-красноватый металл, служащий для получения легкоплавких сплавов. 2. Лекарственное вещество, приготовленное из препаратов этого элемента. [лат. Bismuthum] Малый академический словарь
- Висмут — (лат. Bismuthum) Bi, химический элемент V группы периодической системы Менделеева; атомный номер 83, атомная масса 208,980; серебристо-серый металл с розоватым оттенком. Природный В. состоит из одного стабильного изотопа 209Bi. В. был известен в 15—16 вв. Большая советская энциклопедия
- висмут — орф. висмут, -а Орфографический словарь Лопатина
- висмут — Ви́смут/. Морфемно-орфографический словарь
- Висмут — (Bismuthum; Bi) химический элемент V группы периодической системы элементов Д.И. Менделеева, ат. номер 83, ат. масса 208,98; в медицине применяются соединения В., обладающие вяжущим и антимикробным действием. Медицинская энциклопедия
- ВИСМУТ — ВИСМУТ (символ Bi), серебристо-белый металл, элемент пятой группы периодической таблицы, впервые выделенный как отдельный элемент в 1753 г. Основными рудами для его получения являются бисмит (Вi2О3) и висмутовый блеск (Bi2S3). Научно-технический словарь
- Висмут — Bi (лат. bismuthum * a. bismuth; н. Wismut; ф. bismuth; и. bismuto), — хим. элемент V группы периодич. системы Mенделеева, ат. н. 83, ат. м. 208,980. Природный B. состоит из одного стабильного изотопа 209Bi; из радиоактивных важнейший — 210Bi. Горная энциклопедия
- висмут — ВИСМУТ -а; м. [лат. Bismuthum] 1. Химический элемент (Bi), хрупкий легкоплавкий металл серебристо-серого цвета с розовым отливом (применяется в металлургии, технике и химии). 2. Лекарственный препарат, содержащий соединения этого металла. ◁ Висмутовый, -ая, -ое. В-ые руды. В-ая мазь. В-ые белила. Толковый словарь Кузнецова
- висмут — ВИСМУТ м. один из металлов, не встречаемых в чистом виде и в деле, а только в окисях и солях; легкоплавкий, белый, с красноватым отливом. Висмутовый, к нему относящ., содержащий его. Висмутовые или шпанские белила. Толковый словарь Даля
- висмут — ВИСМУТ, а, м. Химический элемент хрупкий легкоплавкий серебристо-белый металл. | прил. висмутовый, ая, ое. Толковый словарь Ожегова
- висмут — [нем. Bismut, Wismut] – хим. элемент, символ Bi, порядковый номер 83, атомный вес 209; тяжёлый легкоплавкий металл красновато-белого цвета; применяется как составная часть легкоплавких сплавов в зубоврачебном деле, а также в противопожарных приборах; азотнокислая соль висмута применяется в медицине Большой словарь иностранных слов
- висмут — В’ИСМУТ, висмута, ·муж. (·иностр. ). Хрупкий металл белого цвета с красноватым отливом (·хим. ). | Порошок или жидкость из соединений этого металла, применяемые в медицине как лечебные средства (·апт. ). Толковый словарь Ушакова
- висмут — висмут м. 1. Химический элемент, серебристо-серый с розоватым отливом легкоплавкий металл, применяющийся в металлургии, технике и химии. 2. Минерал, отложение горячих глубинных водных источников, содержащий этот элемент. 3. Лекарственный препарат, содержащий соединения этого элемента. Толковый словарь Ефремовой
- ВИСМУТ — ВИСМУТ (лат. Wismuthum) — Bi, химический элемент V группы периодической системы, атомный номер 83, атомная масса 208,9804. Серебристо-белый металл, хрупкий, легкоплавкий; плотность 9,80 г/см3, tпл 271,4 °С. В сухом воздухе устойчив. Большой энциклопедический словарь
- висмут — ви́смут из нем. Wismuth; см. Горяев, ЭС 49. Этимологический словарь Макса Фасмера
- Висмут — (химич. знак Bi, от Bismuthum) представляет белый с красноватым рефлексом блестящий металл; он кристаллизуется с большою легкостью из расплавленного состояния в виде ромбоэдров [Хорошо образованные кристаллы можно получить только из весьма чистого... Энциклопедический словарь Брокгауза и Ефрона
