висмута галогениды
ВИСМУТА ГАЛОГЕНИДЫ
Наиболее изучены тригалогениды BiHal3 (см. табл.). Эти соед. гидролизуются водой (В1Р3 — при кипячении), ее парами и влажным воздухом с образованием оксигалогенидов BiOHal; с галогенидами щелочных металлов и аммония образуют галогенвисмутаты(III): M[BiHal4], M2[BiHal5], а также М[Bi3Hal10] (Hal = F), M3[BiHal6], M3[Bi2Hal9] (Hal = Cl, Br, I). BiHal3 (кроме BiF3) дают аддукты со многими орг. соединениями.
СВОЙСТВА ТРИГАЛОГЕНИДОВ ВИСМУТА

Трифторид BiF3 — бесцветные кристаллы с ромбич. решеткой (а = 0,65614 нм, Ь = 0,70153 нм, с = 0,48414 нм, z = 4, пространственная группа Рпта); плохо раств. в воде и фтористоводородной кислоте (~ 10−3% по массе), раств. в муравьиной, пропионовой и молочной кислотах; образует моногидрат. Получают взаимод. Bi2O3 или Bi(OH)3 с газообразным HF или его водными растворами. При гидролизе BiF3 при нагр. или сплавлении его с Bi2O3 образуются фазы состава BiOxF3_2x, которые (при 0,02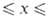 0,17) наряду с M[BiF4] (М = К, Rb) применяют как твердые электролиты в хим. источниках тока.
0,17) наряду с M[BiF4] (М = К, Rb) применяют как твердые электролиты в хим. источниках тока.
Трихлорид В1Cl3 — бесцв., гигроскопичные кристаллы с кубич. решеткой; раств. в неорг. и орг. кислотах, этаноле, ацетоне, эфире; образует моногидрат. Получают взаимод. Bi с Cl2 выше 200 °C, растворением Bi или Bi2O3 в соляной кислоте с послед. упариванием раствора и перегонкой. Применяют как катализатор гидратации олефинов, присоединения HCl и хлорорг. соед. к олефинам, замещения с образованием C—C и C—C1 связей.
Трибромид В1Br3 — лимонно-желтые гигроскопичные кристаллы с моноклинной решеткой; раств. в орг. и неорг. кислотах, ацетоне, жидком NH3; в растворах присоединяет Br2, образуя Bi(Br3)3 и Bi(Br5)3. Получают взаимод. Bi с жидким Br2 или его парами (ок. 250 °C) с послед. перегонкой. Применяют как катализатор присоединения HBr к ненасыщ. орг. соединениям.
Трииодид BiI3 — темно-красные кристаллы с металлич. блеском, решетка гексагональная; хорошо раств. в ацетоне, метаноле и этаноле; в растворах присоединяет I2, образуя Bi(I3)3. Получают взаимод. Bi с I2 при 150–180 °C с послед. перегонкой. Применяют в аналит. химии для определения Cs.
Известен также пентафторид BiF5 — бесцветные кристаллы, решетка тетрагональная; т. пл. 151 °C, т. кип. 230 °C; плотн. 5,4 г/см3; легко гидролизуется; получают взаимод. Bi или BiF3 с F2; сильный фторирующий агент.
Оксигалогениды BiOHal — бесцв. (кроме темно-оранжевого BiOI) кристаллы с тетрагон. решеткой, пространственная группа P4/nmm, z = 2; не раств. в воде; термически неустойчивы (кроме BiOF).
Оксихлорид BiOCl-т. пл. 232,5 °C, т. разл. 575 °C; плотн. 7,760 г/см3; 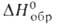 −367 кДж/моль; раств. в неорг. кислотах. Получают взаимод. раствора Bi(NO3)3 в разбавл. HNO3 с раствором NaCl. Применяют как компонент косметич. средств. В природе BiOС1- минерал бисмоклит.
−367 кДж/моль; раств. в неорг. кислотах. Получают взаимод. раствора Bi(NO3)3 в разбавл. HNO3 с раствором NaCl. Применяют как компонент косметич. средств. В природе BiOС1- минерал бисмоклит.
Оксибромид BiOBr-т. разл. 560 °C; плотн. 8,106 г/см3; 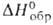 −297 кДж/моль. Получают взаимод. Bi2O3 с кипящим разб. раствором HBr; антисептич. средство в ветеринарии. Оксииодид BiOI — т. разл. 300 °C; плотн. 8,013 г/см3. Получают взаимод. раствора Bi(NO3)3 в ледяной CH3COOH с KI и CH3COONa. Известны также оксигалогениды др. составов, напр. Bi4O5Cl2, Bi5O7I.
−297 кДж/моль. Получают взаимод. Bi2O3 с кипящим разб. раствором HBr; антисептич. средство в ветеринарии. Оксииодид BiOI — т. разл. 300 °C; плотн. 8,013 г/см3. Получают взаимод. раствора Bi(NO3)3 в ледяной CH3COOH с KI и CH3COONa. Известны также оксигалогениды др. составов, напр. Bi4O5Cl2, Bi5O7I.
В твердом состоянии выделены (Bi9)2[BiCl5]4[Bi2Cl8], Bi6Hal7 (Hal = Cl, Br), содержащие кластерный катион Bi95+ и Bi4Hal4 (Hal = Br, I). Известны газообразные моногалогениды BiHal.
Лит. см. при ст. висмут.
Г. В. Зимина, Э. Г. Раков
