висмута оксиды
ВИСМУТА ОКСИДЫ
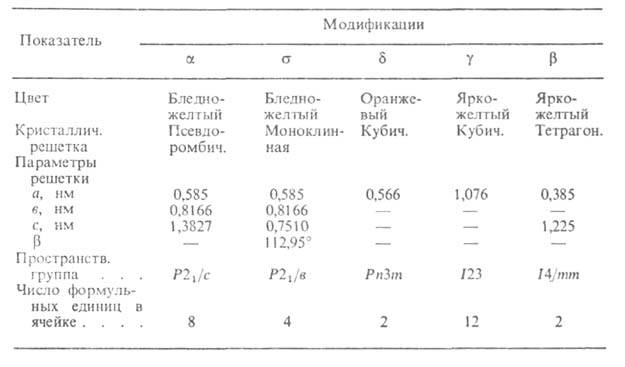
Сесквиоксид Bi2O3-единственный устойчивый при нагр. на воздухе В. о. Существует в двух стабильных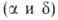 и двух метастабильных (
и двух метастабильных (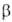 и
и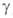 ) модификациях (см. табл.). Для
) модификациях (см. табл.). Для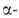 Bi2O3: плотн. 8,9 г/см3; С°р 114 Дж/(моль∙К);
Bi2O3: плотн. 8,9 г/см3; С°р 114 Дж/(моль∙К); 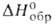 −578 кДж/моль; S0298 151,6 Дж/(моль∙К); теплопроводность ~ 0,8 Вт/(м∙К);
−578 кДж/моль; S0298 151,6 Дж/(моль∙К); теплопроводность ~ 0,8 Вт/(м∙К); 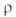 (Ом∙см); 2,34∙108 (225 °C), 1,44∙105 (424 °C), 6,01∙103 (650 °C); полупроводник р-типа.
(Ом∙см); 2,34∙108 (225 °C), 1,44∙105 (424 °C), 6,01∙103 (650 °C); полупроводник р-типа.
Полиморфные превращ. Bi2O3 сопровождаются выделением или поглощением O2 и поэтому зависят от давления O2.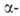 Форма характеризуется полной занятостью узлов кислородной подрешетки, при нагр. частично теряет кислород; при ~727 °C превращ. в
Форма характеризуется полной занятостью узлов кислородной подрешетки, при нагр. частично теряет кислород; при ~727 °C превращ. в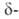 форму Bi2O3_x (x = = 0,045–0,37),
форму Bi2O3_x (x = = 0,045–0,37), 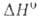 перехода 41 кДж/моль; т. пл. 825 С; плотн. 8,2 г/см3;
перехода 41 кДж/моль; т. пл. 825 С; плотн. 8,2 г/см3; 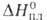 16,3 кДж/моль. Нагретая в среде кислорода
16,3 кДж/моль. Нагретая в среде кислорода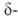 форма (имеет вакантные узлы кислородной подрешетки) при охлаждении поглощает O2, а при 635 °C превращ. в
форма (имеет вакантные узлы кислородной подрешетки) при охлаждении поглощает O2, а при 635 °C превращ. в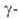 форму (Bi2O3+x), представляющую собой твердый раствор кислорода в Bi2O3.
форму (Bi2O3+x), представляющую собой твердый раствор кислорода в Bi2O3.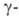 Форма стабильна при комнатной температуре, обладает пьезоэлектрич., электрооптич. и акустооптич. свойствами. При охлаждении нагретой на воздухе
Форма стабильна при комнатной температуре, обладает пьезоэлектрич., электрооптич. и акустооптич. свойствами. При охлаждении нагретой на воздухе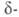 формы при ~ 646 °C образуется β-форма, которая при 620–605 °C превращ. в
формы при ~ 646 °C образуется β-форма, которая при 620–605 °C превращ. в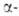 форму. Увеличение парциального давления O2 повышает температуру этого перехода и сужает температурный интервал существования
форму. Увеличение парциального давления O2 повышает температуру этого перехода и сужает температурный интервал существования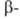 формы; она особенно устойчива, когда ее состав отвечает формуле Bi2O2,7_2,8. После плавления Bi2O3 в среде O2 и последующего охлаждения образуется только
формы; она особенно устойчива, когда ее состав отвечает формуле Bi2O2,7_2,8. После плавления Bi2O3 в среде O2 и последующего охлаждения образуется только форма. Влияние примесей некоторых оксидов (напр., SiO2, GeO2, B2O3, ZnO) аналогично влиянию избытка кислорода.
форма. Влияние примесей некоторых оксидов (напр., SiO2, GeO2, B2O3, ZnO) аналогично влиянию избытка кислорода.
ХАРАКТЕРИСТИКА КРИСТАЛЛИЧЕСКИХ МОДИФИКАЦИЙ Bi2O3
Сесквиоксид не раств. в воде, плохо раств. в растворах щелочей, с кислотами образует соли Bi(III). При 450–550 °C реагирует с большинством оксидов, гидроксидов и карбонатов металлов с образованием сложных оксидов. Получают взаимод. Bi(NO3)3 с избытком щелочи. Применяют как вяжущее и антисептич. лекарственное средство, флюс в производстве эмалей, керамики, фарфора, хрусталя, спец. стекол. Его используют для получения оксидов типа силленита, напр. силикосилленита Bi12SiO20 (служат материалами элементов линий ультразвуковой задержки, модуляторов света и др. в акустооптике и электрооптике) и эвлитина, напр. Bi4Si3O12 (материалы чувствительных элементов сцинтилляционных счетчиков). В природе — минерал бисмит.
Монооксид BiO — черное твердое вещество; т. пл. ~902 °C, т. кип. ~1647 °C; плотн. 7,15–7,20 г/см3; образуется при окислении кислородом Na3Bi в жидком NH3. Диоксид BiO2 — коричневые кристаллы; плотн. 5,6 г/см3; получают окислением Bi(OH)3 в водном аммиаке. Пентаоксид дивисмута Bi2O5 — коричневые или темно-красные кристаллы; плотн. 5,10 г/см3; взаимод. с соляной кислотой с выделением Cl2, с щелочами образует висмутаты, с водой не реагирует; сильный окислитель; образуется при окислении хлором суспензии Bi2O3 в водном растворе KOH при нагр. до ~100 °C.
Известны также гемиоксид Bi2O и оксиды Bi6O7, Bi8O11.
Лит. см. при ст. Висмут.
А. А. Майер
