вода
ВОДА (оксид водорода) H2O
мол. м. 18,016, простейшее устойчивое соед. водорода с кислородом. Жидкость без запаха, вкуса и цвета.
Распространение в природе. В. — одно из самых распространенных на Земле соединений. Молекулы В. обнаружены в межзвездном пространстве. В. входит в состав комет, большинства планет солнечной системы и их спутников. Количество В. на поверхности Земли оценивается в 1,39∙1018 т, большая часть ее содержится в морях и океанах. Количество доступных для использования пресных В. в реках, озерах, болотах и водохранилищах составляет 2∙104 т. Масса ледников Антарктики, Антарктиды и высокогорных районов 2,4∙1016т, примерно столько же имеется подземных вод, причем только небольшая их часть — пресные. В глубинных слоях Земли содержится значительно больше (повидимому, не менее, чем на порядок) В., чем на поверхности. В атмосфере находится ок. 1,3∙1013 т В. Вода входит в состав мн. минералов и горных пород (глины, гипс и др.), присутствует в почве, является обязат. компонентом всех живых организмов.
Изотопный состав. Существует 9 устойчивых изотопных разновидностей В. Содержание их в пресной воде в среднем следующее (мол. %): 1H216O — 99,13; 1H218O — 0,2; 1H2170-0,04; 1H2O16O-0,03; остальные пять изотопных разновидностей присутствуют в В. в ничтожных количествах. Кроме стабильных изотопных разновидностей, в В. содержится небольшое количество радиоактивного 3H2 (или Т2O). Изотопный состав прир. В. разного происхождения неск. варьирует. Особенно непостоянно отношение 1Н/2Н: в пресных В. — в среднем 6900, в морской В.-5500, во льдах — 5500–9000. По физ. свойствам D2O заметно отличается от обычной В. (см. тяжёлая вода). В., содержащая 18O, по свойствам ближе к В. с 16O.
Строение молекулы и физические свойства. Атомы водорода и кислорода в молекуле В. расположены в углах равнобедренного треугольника с длиной связи O—H 0,0957 нм; валентный угол Н—О—Н 104,5°; дипольный момент 6,17∙10−30 Кл∙м; поляризуемость молекулы 1,45∙10−3 нм3; средний квадрупольный момент — 1,87∙10−41 Кл∙м2, энергия ионизации 12,6 эВ, сродство к протону 7,1 эВ. При взаимодействии молекулы В. с др. атомами, молекулами и ионами, в т. ч. с другими молекулами В. в конденсир. фазах, эти параметры изменяются.
Некоторые параметры, характеризующие свойства В. в разных агрегатных состояниях при атм. давлении, приведены ниже (см. также табл. 1 и рис. 1, на котором указаны области существования разл. модификаций льда):

Физ. свойства В. аномальны. Плавление льда при атм. давлении сопровождается уменьшением объема на 9%. Температурный коэф. объемного расширения льда и жидкой воды отрицателен при температурах соотв. ниже −210 °C и 3,98 °C. Теплоемкость C0 при плавлении возрастает почти вдвое и в интервале 0–100 °C почти не зависит от температуры (имеется минимум при 35 °C). Минимум изо-термич. сжимаемости (44,9∙10−11 Па−1), наблюдаемый при 46 °C, выражен довольно четко. При низких давлениях и температурах до 30 °C вязкость В. с ростом давления падает. Высокие диэлектрич. проницаемость и дипольный момент В. определяют ее хорошую растворяющую способность по отношению к полярным и ионогенным веществам. Благодаря высоким значениям С°, 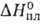 и
и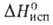 вода-важный регулятор климатич. условий на земле, стабилизирующий температуру на ее поверхности. Кроме того, близость угла Н—О—Н к тетраэдрическому (109° 28') обусловливает рыхлость структур льда и жидкой воды и, как следствие, аномальную зависимость плотности от температуры. Поэтому не промерзают до дна крупные водоемы, что делает возможным существование в них жизни.
вода-важный регулятор климатич. условий на земле, стабилизирующий температуру на ее поверхности. Кроме того, близость угла Н—О—Н к тетраэдрическому (109° 28') обусловливает рыхлость структур льда и жидкой воды и, как следствие, аномальную зависимость плотности от температуры. Поэтому не промерзают до дна крупные водоемы, что делает возможным существование в них жизни.
Табл. 1 — СВОЙСТВА ВОДЫ И ВОДЯНОГО ПАРА, НАХОДЯЩИХСЯ В РАВНОВЕСИИ
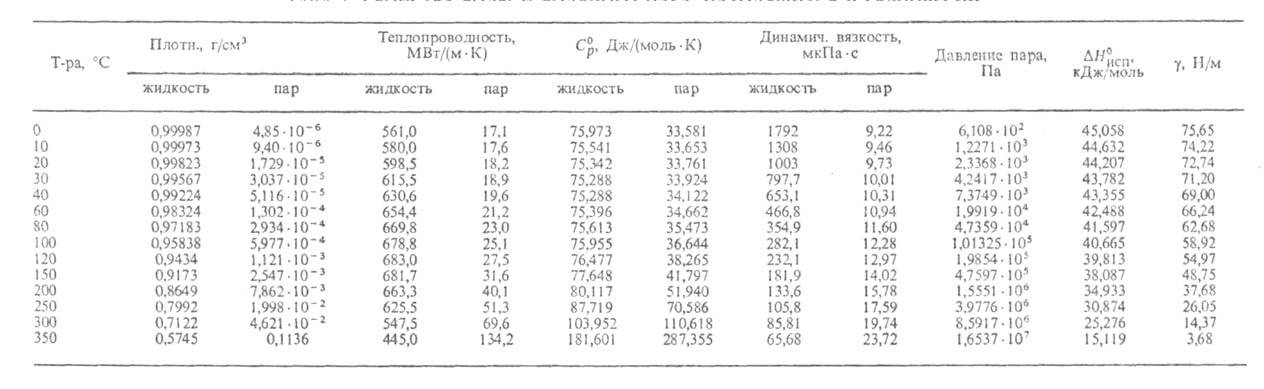
Рис. 1. Фазовая диаграмма воды.
Взаимодействие между молекулами воды. Структура конденсированных фаз. Молекулы В., обладая значит. ди-польным моментом, сильно взаимод. друг с другом и полярными молекулами др. веществ. При этом атомы водорода могут образовывать водородные связи с атомами О, N, F, Cl, S и др. В водяном паре при невысоких температурах и умеренных давлениях присутствует небольшое количество (ок. 1% при температуре кипения и атм. давлении) димеров В. (для них ~ 15 кДж/моль), расстояние между атомами кислорода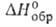 ~ 0,3 нм. В конденсиров. фазах каждая молекула В. образует четыре водородные связи: две — как донор протонов и две — как акцептор протонов. Средняя длина этих связей в кристаллич. модификациях льда и кристаллогидратах ок. 0,28 нм. Угол О—Н...О стремится к 180°. Четыре водородные связи молекулы В. направлены приблизительно к вершинам правильного тетраэдра (рис. 2).
~ 0,3 нм. В конденсиров. фазах каждая молекула В. образует четыре водородные связи: две — как донор протонов и две — как акцептор протонов. Средняя длина этих связей в кристаллич. модификациях льда и кристаллогидратах ок. 0,28 нм. Угол О—Н...О стремится к 180°. Четыре водородные связи молекулы В. направлены приблизительно к вершинам правильного тетраэдра (рис. 2).
Структура модификаций льда представляет собой трехмерную сетку. В плотных модификациях VI-VIII, устойчивых при высоких давлениях, можно даже выделить две такие сетки, "вставленные" одна в другую. В модификациях, существующих при низких давлениях (льды Ih и Iс), связи Н—О—Н почти прямолинейны и направлены к вершинам практически правильного тетраэдра. В модификациях II-VI связи искривлены и углы между ними отличаются от тетраэдрического, что обусловливает увеличение плотности по сравнению с плотностью обычного льда.
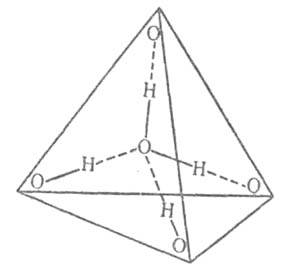
Рис. 2. Схема тетраэдрич. координации молекулы воды; сплошные линии — ковалентные связи; пунктирные линии — водородные связи.
Но плотность модификаций II-VI значительно ниже той, которой мог бы обладать лёд при плотной упаковке молекул. Только в модификациях VII и VIII достигается достаточно высокая плотность упаковки: в их структуре две правильные сетки, построенные из тетраэдров (аналогичные существующим в кубич. низкотемпературном льде Iс, изоструктурном алмазу), вставлены одна в другую; при этом сохраняется система прямолинейных водородных связей, а координац. число по кислороду удваивается и достигает 8. Расположение атомов кислорода во льдах VII и VIII подобно расположению атомов в α-железе и многих др. металлах. В обычном (Ih) и кубическом (Iс) льдах, а также во льдах HI, V-VII ориентация молекул не определена: оба ближайших к атому О протона образуют с ним ковалентные связи, которые м. б. направлены к любым двум из четырех соседних атомов кислорода в вершинах тетраэдра. Диэлектрич. проницаемость этих модификаций высока (выше, чем у жидкой В.). Модификации II, VIII и IX ориентационно упорядочены; их диэлектрич. проницаемость низка (ок. 3). Лед VIII представляет собой упорядоченный по размещению протонов вариант льда VII, а лед IX — льда III. Плотности ориентационно упорядоченных модификаций (VIII, IX) близки к плотностям соответствующих неупорядоченных (VII, III).
Трехмерная сетка водородных связей, построенная из тетраэдров, существует и в жидкой В. во всем интервале от температуры плавления до критической. Увеличение плотности при плавлении, как и в случае плотных модификаций льда, объясняется искривлением водородных связей и отклонением углов между ними от тетраэдрических. Искривление связей увеличивается с ростом температуры и давления, что приводит к возрастанию плотности. С др. стороны, при нагр. средняя длина водородных связей становится больше, в результате чего плотность уменьшается. Совместное действие двух факторов объясняет наличие максимума плотности В. при 3,98 °C.
Химические свойства. Лишь незначит. доля молекул (при 25 °C — примерно 1 на 5∙109) подвергается электролитич. диссоциации по схеме: H2O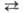 H+ + OH−. Протон H+ в водной среде, взаимодействуя с молекулами В., образует H3O+ , объединяющийся с 1 молекулой H2O в H5O2+. Расстояние О...О в таких комплексах заметно короче длины нормальной водородной связи между нейтральными молекулами. Но поскольку протон, по-видимому, находится не точно посредине этой укороченной связи, а ближе к одному из атомов О, можно считать, что в В. существует гидратированный ион оксония H3O+. Это явление играет большую роль в хим. процессах, происходящих в разл. системах, в т. ч. биологических. В частности, диссоциация В. — причина гидролиза солей слабых кислот и (или) оснований. Концентрация ионов H+ и связанная с ней концентрация ионов OH− — важные характеристики водных растворов (см. водородный показатель). Степень электролитич. диссоциации В. заметно возрастает при повышении температуры.
H+ + OH−. Протон H+ в водной среде, взаимодействуя с молекулами В., образует H3O+ , объединяющийся с 1 молекулой H2O в H5O2+. Расстояние О...О в таких комплексах заметно короче длины нормальной водородной связи между нейтральными молекулами. Но поскольку протон, по-видимому, находится не точно посредине этой укороченной связи, а ближе к одному из атомов О, можно считать, что в В. существует гидратированный ион оксония H3O+. Это явление играет большую роль в хим. процессах, происходящих в разл. системах, в т. ч. биологических. В частности, диссоциация В. — причина гидролиза солей слабых кислот и (или) оснований. Концентрация ионов H+ и связанная с ней концентрация ионов OH− — важные характеристики водных растворов (см. водородный показатель). Степень электролитич. диссоциации В. заметно возрастает при повышении температуры.
Образование В. из элементов по реакции H2 + 1/2O2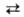 H2O (
H2O (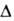 H0обр −242 кДж/моль для пара и −286 кДж/моль для жидкой В.) при низких температурах в отсутствие катализаторов происходит крайне медленно, но скорость реакции резко возрастает при повышении температуры, и при 550 °C она происходит со взрывом. При снижении давления и возрастании температуры равновесие сдвигается влево. Степень термич. диссоциации В. (%) при 100 кПа: 0,034 (1015 °C), 0,74 (1711 °C), 8,6 (2215 °C) и 11,1 (2483 °C). Под действием УФ-излучения происходит фотодиссоциация В. на ионы H+ и OH−. Ионизирующее излучение вызывает радиолиз В. с образованием H2, H2O2 и своб. радикалов
H0обр −242 кДж/моль для пара и −286 кДж/моль для жидкой В.) при низких температурах в отсутствие катализаторов происходит крайне медленно, но скорость реакции резко возрастает при повышении температуры, и при 550 °C она происходит со взрывом. При снижении давления и возрастании температуры равновесие сдвигается влево. Степень термич. диссоциации В. (%) при 100 кПа: 0,034 (1015 °C), 0,74 (1711 °C), 8,6 (2215 °C) и 11,1 (2483 °C). Под действием УФ-излучения происходит фотодиссоциация В. на ионы H+ и OH−. Ионизирующее излучение вызывает радиолиз В. с образованием H2, H2O2 и своб. радикалов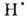
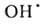
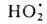 ; радиац. выход — примерно 4 распавшиеся молекулы на каждые 1,6∙10−17 Дж поглощенной энергии излучения.
; радиац. выход — примерно 4 распавшиеся молекулы на каждые 1,6∙10−17 Дж поглощенной энергии излучения.
В. — реакционноспособное соединение. Она окисляется атомарным кислородом: H2O + О → H2O2. При взаимодействии В. с F2 образуются HF, а также О, O2, O3, H2O2, F2O и др. соединения. С остальными галогенами при низких температурах В. реагирует с образованием смеси кислот HHal и НHalO. При обычных условиях с В. взаимод. до половины растворенного в ней Cl2 и значительно меньшие количества Br2 и 12. При повыш. температурах хлор и бром разлагают В. с образованием HHal и O2. При пропускании паров В. через раскаленный уголь она разлагается и образуется т. наз. водяной газ: H2O + С CO + H2. При повыш. температуре в присутствии катализатора В. реагирует с CO, CH4 и др. углеводородами, напр.: H2O + CO
CO + H2. При повыш. температуре в присутствии катализатора В. реагирует с CO, CH4 и др. углеводородами, напр.: H2O + CO CO2 + H2 (кат. Fe); H2O + CH4
CO2 + H2 (кат. Fe); H2O + CH4 CO + ЗH2 (кат. Ni или Со). Эти реакции используют для пром. получения H2. Перспективны для его производства также термохим. способы разложения В. (см. водород, водородная энергетика). Фосфор при нагр. с В. под давлением в присутствии катализатора окисляется в метафосфорную кислоту: 6H2O + ЗР → 2HPO3 + 5H2. Вода взаимод. со мн. металлами с образованием H2 и соответствующего гидроксида. Со щелочными и щел.-зем. металлами (кроме Mg) эта реакция протекает уже при комнатной температуре. Менее активные металлы разлагают В. при повышенной температуре, напр. Mg и Zn-выше 100 °C, Fe — выше 600 °C (2Fe + ЗH2O → Fe2O3 + 3H2). При взаимодействии с В. многих оксидов образуются кислоты или основания. В. может служить катализатором, напр. щелочные металлы и водород реагируют с хлором только в присутствии следов В. Иногда В. — каталитич. яд, напр. для железного катализатора при синтезе NH3.
CO + ЗH2 (кат. Ni или Со). Эти реакции используют для пром. получения H2. Перспективны для его производства также термохим. способы разложения В. (см. водород, водородная энергетика). Фосфор при нагр. с В. под давлением в присутствии катализатора окисляется в метафосфорную кислоту: 6H2O + ЗР → 2HPO3 + 5H2. Вода взаимод. со мн. металлами с образованием H2 и соответствующего гидроксида. Со щелочными и щел.-зем. металлами (кроме Mg) эта реакция протекает уже при комнатной температуре. Менее активные металлы разлагают В. при повышенной температуре, напр. Mg и Zn-выше 100 °C, Fe — выше 600 °C (2Fe + ЗH2O → Fe2O3 + 3H2). При взаимодействии с В. многих оксидов образуются кислоты или основания. В. может служить катализатором, напр. щелочные металлы и водород реагируют с хлором только в присутствии следов В. Иногда В. — каталитич. яд, напр. для железного катализатора при синтезе NH3.
Способность молекул В. образовывать трехмерные сетки водородных связей позволяет ей давать с инертными газами, углеводородами, CO2, Cl2, (CH2)2O, CHCl3 и многими др. веществами т. наз. газовые гидраты.
Вода как растворитель. В. хорошо растворяет мн. полярные и диссоциирующие на ионы вещества. Обычно растворимость возрастает с увеличением температуры, но иногда температурная зависимость имеет более сложный характер. Так, растворимость мн. сульфатов, карбонатов и фосфатов при повышении температуры уменьшается или сначала повышается, а затем проходит через максимум. Растворимость малополярных веществ (в т. ч. газов, входящих в состав атмосферы) в В. низкая и при повышении температуры обычно сначала снижается, а затем проходит через минимум. С ростом давления растворимость газов возрастает, проходя при высоких давлениях через максимум. Многие вещества, растворяясь в В., реагируют с ней. Например, в растворах NH3 могут присутствовать ионы NH4 (см. также гидролиз). Между растворенными в В. ионами, атомами, молекулами, не вступающими с ней в хим. реакции, и молекулами В. существуют не разрушающие их ион-дипольные и межмол. взаимодействия (см. гидратация).
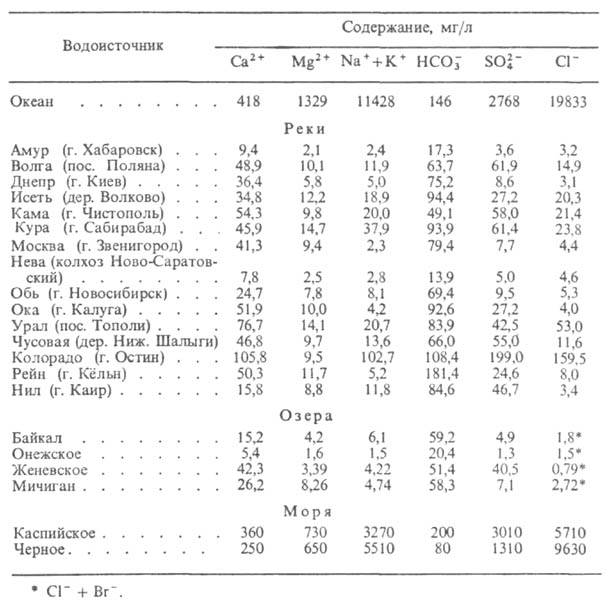
Природная вода. Представляет собой сложную многокомпонентную систему, в состав которой входят минер. вещества, газы, а также коллоидные и крупнодисперсные частицы, в т. ч. микроорганизмы. По величине минерализации (г/л) различают след. природные В.: ультрапресные — до 0,2, пресные — 0,2–0,5, слабоминерализованные — 0,5–1,0, солоноватые — 1–3, соленые — 3–10, с повыш. соленостью — 10–35, переходные к рассолам — 35–50, рассолы — более 50. Макрокомпонентами прир. В. обычно являются Ca, Mg, Na, К, Fe (катионогенные В.), Si, С, S, C1 (анионогенные В.). К микрокомпонентам прир. В. относятся редкие и рудные элементы, напр. В, Li, Rb, Cu, Zn, Bi, Be, W, U, Br, I и др.
Осн. газы, содержащиеся в прир. В., — CO2, N2 (характерны как для поверхностных, так и для глубинных условий), CH4, CO, H2 (более типичны для подземных В. и для В. вулканич. активных областей). Растворенные в В. компоненты находятся в равновесии, образуя комплексы разл. состава. Данные о составе некоторых прир. В. приведены в табл. 2.
Табл. 2 — СОСТАВ ПРИРОДНЫХ ВОД
Питьевая вода. Общее число микроорганизмов в 1 мл питьевой В. должно быть не выше 100, число бактерий группы кишечных палочек (коли-индекс) — не более 3. Концентрация хим. веществ, которые встречаются в прир. В. или добавляются к В. при ее обработке (см. водоподготовка), не должна превышать (мг/л):

Содержание примесей, которые влияют на органолептич. свойства В. и встречаются в прир. В. или добавляются к В. при ее обработке, не должно превышать (мг/л):

Общая жесткость питьевой В. должна быть не выше 7,0 ммоль/л, сухой остаток — 1000 мг/л, pH — от 6,0 до 9,0. Для питьевой В., подаваемой без спец. обработки, по согласованию с органами санитарно-эпидемиологич. службы допускаются след. показатели: сухой остаток — до 1500 мг/л, общая жесткость — до 10 ммоль/л, содержание железа и марганца — соотв. до 1 и до 0,5 мг/л.
Техническая вода. В., расходуемую пром. предприятиями, принято наз. технической. Ее применяют гл. обр. в качестве охлаждающего агента, транспортирующей среды для сыпучих материалов (напр., гидротранспорт золы на тепловых электростанциях), растворителя и др. В целом по всем отраслям промышленности 70–75% от общего расхода В. применяют как хладагент по циркуляц. схеме. В этом случае В. лишь нагревается и практически не загрязняется. Главные источники загрязнения охлаждающей В. систем циркуляц. водоснабжения — В., добавляемая в системы для восполнения неизбежных потерь, и атм. воздух, из к-poro вымываются в охладителях В. взвешенные вещества и газы, растворимые в воде.
Осн. ионами, которые могут приводить к отложениям минер. солей в системах циркуляц. водоснабжения, являются анионы НCO3−, CO32−, OH−, SOl42−, PO43−, SiO32−, а также катионы Ca2+, Mg2+ , Fe2+,3+ , A13+ , Zn2+. Наиб. часто встречающийся компонент солевых отложений — CaCO3 (см. жесткость воды). Предотвратить отложение карбонатов можно подкислением воды H2SO4 или HCl, ее рекарбонизацией (обычно обработка топочными газами, содержащими CO2), действием полифосфатов (NaPO3)6 и Na5P3O10, орг. фосфатов и др. Для предотвращения (уменьшения) коррозии труб и теплообменного оборудования в В. добавляют ингибиторы коррозии: полифосфаты, ингибиторы на основе хромато-цинковых смесей и др. Для предупреждения обрастания оборудования бактериями В. в основном хлорируют (содержание Cl2 до 5 мг/л), а иногда озонируют.
Лечебные воды. В качестве лечебных применяют прир. В., содержащие значит. количество минер. солей, газы, некоторые элементы и др. (подробнее см. минеральные воды).
Лит.: Хорн Р., Морская химия, пер. с англ., М., 1972; Эйзенберг Д., Кауцман В., Структура и свойства воды, пер. с англ., Л., 1975; Самойлов О. Я., Структура водных растворов электролитов и гидратация ионов, М., 1957 Алекин О. А., Основы гидрохимии, Л., 1970; Синюков В. В., Структура одноатомных жидкостей, воды и водных растворов электролитов, М., 1976; Унифицированные методы исследования качества вод, ч. 1, кн. 2–3. Методы химического анализа вод, М., 1977; Кульский Л.А., Даль В.В., Чистая вода и перспективы ее сохранения, К., 1978; Возная Н. Ф., Химия воды и микробиология, 2 изд., М., 1979; Перельман А.И., Геохимия природных вод, М., 1982; Маленков Г. Г., в кн.: Физическая химия. [Ежегодник], М., 1984, с. 41–76.
Г. Г. Маленков, С. В. Яковлев, В. А. Гладков
Значения в других словарях
- ВОДА — Одна из фундаментальных стихий мироздания. В самых различных мифологиях В. — первоначало, исходное состояние всего сущего, эквивалент первобытного хаоса; ср. встречающийся в большинстве мифологий мотив подъятая мира (земли) со дна первичного океана. Мифологическая энциклопедия
- Вода — Окись водорода, H20, простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% водорода и 88,81% кислорода по массе), молекулярная масса 18,0160... Большая советская энциклопедия
- вода — орф. вода, -ы, мн. воды, вод, водам Орфографический словарь Лопатина
- вода — Древнерусское – вода. Старославянское – вода. Общеславянское – voda. Слово «вода» – славянское по происхождению, известно в русском языке с XI в. и образовано от той же общеславянской основы, что и слово «ведро». Этимологический словарь Семёнова
- вода — ВОДА, окись водорода, H2О, простейшее устойчивое в обычных условиях химич. соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Мол. м. 18, 0,160, t замерзания 0° (при 1 ат), t кипения 100°С (при 1 ат), плотность (при t 4°С) 1,0. Ветеринарный энциклопедический словарь
- вода — Воду толочь (в ступе) (разг.) — заниматься непроизводительным трудом, бесполезной работой. ► Кончай воду в ступе толочь, надо уроки делать. Как в воду опущенный — имеющий унылый вид, печальный. ► После ссоры оба ходили, как в воду опущенные. Фразеологический словарь Волковой
- вода — ВОДА - вода в бассейнах. Должна удовлетворять требованиям, предъявляемым к питьевой воде (для занятий плаванием можно использовать морскую и минеральную воду). Температурный режим воды в бассейнах в пределах 24-28 градусов по С, осуществляется подогревом. Словарь спортивных терминов
- Вода — I. В. в природе Палестины (см. Палестина IV): см. Дождь см. Снег см. Поток см. Иордан см. Средиземное море см. Соленое море см. Чермное море см. Река. II. Снабжение В. деревень и городов: см. Колодец см. Водоем см. Иерусалим (II,В) см. Силоам. III. Библейская энциклопедия Брокгауза
- вода — Пустой разговор Словарь воровского жаргона
- Вода — (Быт 1:6, 9:10 и др.). Как высоко ценилась в древности израильтянами вода, этот необходимейший дар для жизни и благосостояния человека, о том Свящ. Писание свидетельствует во многих местах. Библейская энциклопедия архим. Никифора
- ВОДА — ВОДА. «Французское еаи как будто вполне равно русской воде; однако образное употребление слова вода в смысле `нечто лишенное содержания' совершенно чуждо французскому слову, а зато последнее имеет значение... Историко-этимологический словарь
- вода — ВОДА, H2O, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая). Простейшее устойчивое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Плота. 1000 г/см3 (3,98°C), tпл 0°C, tкип 100°C. Сельскохозяйственный словарь
- вода — Бросить деньги в воду, быть точно в воду опущенным, выводить на свежую воду, выводить на чистую воду, выйти сухим из воды, и в воде тонуть, и в огне гореть, идти в огонь и в воду, как в воду кануть, как воды в рот набрать, как две капли воды... Словарь синонимов Абрамова
- вода — Вод’а — одно из наиболее часто встречающихся слов в Библии. Известно, вода — это жизнь. Это особенно относится к такой жаркой стране, как Палестина... Библейский словарь Вихлянцева
- вода — Вод/а́. Морфемно-орфографический словарь
- вода — сущ., ж., употр. наиб. часто (нет) чего? воды, чему? воде, (вижу) что? воду, чем? водой, о чём? о воде; мн. что? воды, (нет) чего? вод, чему? водам, (вижу) что? воды, чем? водами, о чём? о водах вода как жидкость... Толковый словарь Дмитриева
- вода — Общеслав. индоевроп. характера (ср. англ. water «вода», др.-инд. uda «вода», лат. unda — тж.), того же корня (с перегласовкой), что и ведро, выдра. Этимологический словарь Шанского
- вода — Бесцветная (в толстых слоях голубоватая ) жидкость без запаха и вкуса; химическое соединение водорода с кислородом (Н2 О ). Состоит из 11,11 % водорода и 88,89 % кислорода (по массе ). География. Современная энциклопедия
- вода — Питьевая, удовлетворяет питьевые потребности человека (ок. 3 л в сутки). Вместе с водой в организм поступают минеральные соли и микроэлементы. Их недостаток или избыток может вызывать различные заболевания, связанные с нарушением водно-солевого баланса. Биология. Современная энциклопедия
- вода — Важнейший и незаменимый продукт в большинстве видов кулинарного производства. Используется в таких основных кулинарных процессах, как варка, тушение, соление, маринование. Кулинарный словарь
- Вода — (Н2О) жидкость без запаха, вкуса, цвета; самое распространенное природное соединение. По физико-химическим свойствам В. отличается аномальным характером констант, которые определяют многие физические и биологические процессы на Земле. Плотность... Медицинская энциклопедия
- ВОДА — ВОДА (Н2О), жидкость без цвета и запаха, покрывающая более 70% поверхности Земли. Самый распространенный растворитель. Без воды не может быть жизни; она составляет 60-70% человеческого тела. Вода представляет собой соединение водорода и кислорода. Научно-технический словарь
- Вода — Важнейший экологический ресурс и главная составляющая живых организмов. Даже в теле взрослого человека при весе в 70 кг на воду приходится 50 кг. Для организмов, обитающих в приземном слое атмосферы и в почве, главным источником В. являются осадки. Экологические термины и определения
- вода — О цвете, степени прозрачности, чистоты; о запахе. Бурая, вечнолазурная (устар. поэт.), вонючая, вязкая, глянцевая, гнилая, голубая, грязная, густая, дегтярная, желтая, желто-лазурная, жемчужная, застойная, затхлая, зеленая, зеркальная, золотая... Словарь эпитетов русского языка
- Вода — (a. water; н. Wasser; ф. eau; и. agua) — широко распространённое в природе простейшее, устойчивое в обычных условиях хим. соединение водорода c кислородом, H2O (11,19% водорода и 88,81 % кислорода, по массе)... Горная энциклопедия
- вода — СУША — ВОДА [Эйнштейн:] Древние говорили, что рядом с добром живет зло, с теплом — холод, с водою — суша, со светом — тьма. С ничем — что-то. Н. Погодин. Альберт Эйнштейн. Словарь антонимов русского языка
- вода — • Безглагольная (Бальмонт). • Весело-синяя (Куприн). • Гордая (Бальмонт). • Дремотствующая (Бальмонт). • Жидкая (Бунин). • Запевшая (Бальмонт). • Зелено-бледная (Бальмонт). • Игристая (Серафимович). • Изумрудная (Бунин). • Лазурная (Фофанов). Словарь литературных эпитетов
- вода — ВОДА -ы, вин. воду, мн. воды, водам и водам, водами и водами; о водах и о водах; ж. 1. Прозрачная, бесцветная жидкость, образующая ручьи, реки, озёра, моря и представляющая собой химическое соединение водорода с кислородом. Речная в. Морская в. В. сырая. Толковый словарь Кузнецова
- вода — ВОДА ж. стихийная жидкость, ниспадающая в виде дождя и снега, образующая на земле родники, ручьи, реки и озера, а в смеси с солями, — моря. Толковый словарь Даля
- вода — ВОДА, ы, вин. воду, мн. воды, вод, водам и (устар.) водам, ж. 1. Прозрачная бесцветная жидкость, представляющая собой химическое соединение водорода и кислорода. Речная, родниковая в. Водопроводная в. Морская в. Стакан воды. Толковый словарь Ожегова
- вода — ВОД’А, воды, вин. воду, мн. воды, водам-водам, ·жен. 1. только ед. Прозрачная, бесцветная жидкость, которая в чистом виде представляет собою химическое соединение кислорода и водорода. Дождевая вода. Морская вода. Колодезная вода. Жесткая, мягкая вода. Толковый словарь Ушакова
- Вода — С древнейших времен стали понимать великое значение воды не только для людей и всяких животных и растительных организмов, но и для всей жизни Земли. Энциклопедический словарь Брокгауза и Ефрона
- вода — Общеславянское слово индоевропейской природы. Та же основа (хотя и с измененной гласной) имеется в слове ведро. Современные английское water и немецкое Wasser восходят к тому же индоевропейскому корню. Этимологический словарь Крылова
- вода — вода I ж. 1. Бесцветная прозрачная жидкость, представляющая собою химическое соединение водорода и кислорода и содержащаяся в атмосфере, почве, живых организмах и т.п. || Жидкость, используемая для утоления жажды, приготовления пищи и т.п. || перен. разг. Толковый словарь Ефремовой
- ВОДА — ВОДА — Н2О, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая); плотность 1,000 г/см3 (3,98 °С) — tпл 0 °С, tкип 100 °С. Одно из самых распространенных веществ в природе (гидросфера занимает 71% поверхности Земли). Большой энциклопедический словарь
- Вода — Одна из фундаментальных стихий мироздания. В самых различных мифологиях В. — первоначало, исходное состояние всего сущего, эквивалент первобытного хаоса; срв. встречающийся в большинстве мифологий мотив подъятия мира (земли) со дна первичного океана. Словарь по культурологии
- вода — вода́ сюда же во́дка, укр., блр. вода́, др.-русск., ст.-слав. вода ὕδωρ (Супр.), болг. вода́, сербохорв. во̀да, словен. vóda, чеш. voda, слвц. voda, польск. woda, в.-луж., н.-луж. woda. Древние ступени чередования представлены в ведро́, вы́дра. Этимологический словарь Макса Фасмера
