водорода пероксид
ВОДОРОДА ПЕРОКСИД (перекись водорода) H2O2
бесцветная жидкость; т. пл. −0,41 °C (легко переохлаждается), т. кип. 150,2 °C; d420 1,450, твердого 1,71 ( −20 °C); tкрит 457 °C, pкрит 21,4 МПа; C0p [Дж/ (моль∙К)]: 89,33, газообразного 42,39; 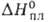 12,50 кДж/ моль, ΔH0исп 51,60 кДж/моль (25 °C), ΔH0обр газообразного −135,88 кДж/моль, жидкого −187,78 кДж/моль; S0298 [Дж/ (моль∙К)]: 109,60, газообразного 234,41;
12,50 кДж/ моль, ΔH0исп 51,60 кДж/моль (25 °C), ΔH0обр газообразного −135,88 кДж/моль, жидкого −187,78 кДж/моль; S0298 [Дж/ (моль∙К)]: 109,60, газообразного 234,41; 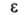 70,7 (25 °C); дипольный момент 2,13∙10−30 Кл∙м (в C6H6, 25 °C);
70,7 (25 °C); дипольный момент 2,13∙10−30 Кл∙м (в C6H6, 25 °C); 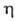 1,245∙10−3 Па∙с;
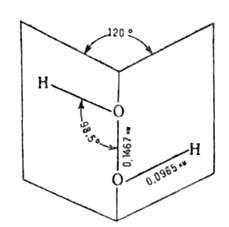
1,245∙10−3 Па∙с; 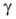 0,0804 Н/м; nD20 1,4077. Кристаллич. решетка тетрагональная (а = 0,406 нм, с = 0,80 нм, z = 4, пространственная группа P41212). Слабая кислота, pKа 11,6 (в воде, 20 °C). Характеристич. полосы поглощения в ИК-спектре: 370 и 880 см−1, 1390 и 1266 см−1, 3598,7 и 3610,7 см−1 (3400 для жидкого H2O2). В.п. смешивается с водой во всех отношениях, образует дигидрат с т. пл. −52,0 °C. Раств. в спирте, эфире. Образует кристаллич. соль-ваты общей формулы R*nH2O2, используемые как твердые носители В. п., напр. Na2CO3*l,5H2O2, CO(NH2)2*H2O2.
0,0804 Н/м; nD20 1,4077. Кристаллич. решетка тетрагональная (а = 0,406 нм, с = 0,80 нм, z = 4, пространственная группа P41212). Слабая кислота, pKа 11,6 (в воде, 20 °C). Характеристич. полосы поглощения в ИК-спектре: 370 и 880 см−1, 1390 и 1266 см−1, 3598,7 и 3610,7 см−1 (3400 для жидкого H2O2). В.п. смешивается с водой во всех отношениях, образует дигидрат с т. пл. −52,0 °C. Раств. в спирте, эфире. Образует кристаллич. соль-ваты общей формулы R*nH2O2, используемые как твердые носители В. п., напр. Na2CO3*l,5H2O2, CO(NH2)2*H2O2.
Чистый H2O2 термически устойчив, при ~20 °C разлагается ок. 0,5% в год. В присут. ионов тяжелых металлов, а также под действием света и при нагр. скорость распада резко увеличивается; разложение H2O2 может происходить со взрывом. Стабильность водных растворов H2O2 растет с увеличением концентрации ионов H3O+ и максимальна при pH 3,5–4,5.
В. п. обладает как окислительными, так и восстановительными свойствами: окисляет I− до I, SO32− до SO42−, Ti3+ до Ti4+, бензол в фенол, анилин в азоксибензол, эпоксидирует ненасыщенные соед.; восстанавливает Ag2O до Ag, MnO4 до Mn2+, Ce4+ до Ce3+ и др. Замещением атомов Н в H2O2 м. б. получены др. пероксидные соединения, напр. пероксиды металлов, диацилпероксиды, диалкилпероксиды.
Основной (свыше 80% мирового производства) пром. способ получения H2O2 — автоокисление алкилантрагидрохинонов, в первую очередь 2-этил-, 2-трет-бутил- и 2-пентилантрагидрохинонов:
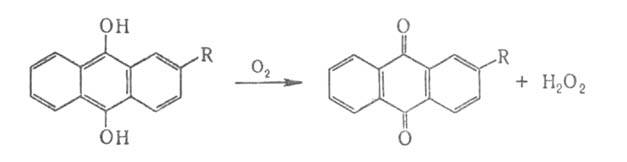
Процесс проводят в смеси C6H6 с вторичными спиртами. В.п. экстрагируют водой, растворы H2O2 концентрируют перегонкой и ректификацией. Образующиеся алкилантрахиноны восстанавливают Н, в присутствии Ni или Pt и вновь используют для получения H2O2. В. п. получают, кроме того, автоокислением изо-C3H7OH [(CH3)2CHOH (CH3)2С(ООН)ОН
(CH3)2С(ООН)ОН (CH3)2CO + H2O2] и C6H5NHNHC6H5, а также анодным окислением разб. H2S04:
(CH3)2CO + H2O2] и C6H5NHNHC6H5, а также анодным окислением разб. H2S04:
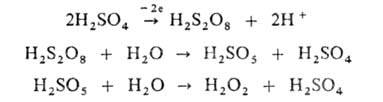
Выпускается H2O2 в виде 30–90%-ных водных растворов (30%-ный раствор, содержащий стабилизирующие добавки, наз. пергидролем).
В. п. применяют: для получения орг. и неорг. пероксидов, пербората и перкарбоната Na; как окислитель в ракетных топливах; при получении эпоксидов, гидрохинона, пирокатехина, этиленгликоля, глицерина, ускорителей вулканизации группы тиурама и др.; для отбеливания масел, жиров, меха, кожи, текстильных материалов, бумаги; для очистки германиевых и кремниевых полупроводниковых материалов (путем перевода нерастворимых в воде примесей в растворимые); при извлечении металлов из руд [напр., окислением UO2 (нерастворимая форма) до UO4 (раств. в воде)]; как дезинфицирующее средство для обезвреживания бытовых и индустриальных сточных вод; в медицине; как источник O2 в подводных лодках; H2O2 входит в состав реактива Фентона (Fe2+ +. H2O2), который используют как источник своб. радикалов OH в орг. синтезе.
Конц. водные растворы H2O2 взрывоопасны, орг. соед. и их растворы, содержащие H2O2, способны к воспламенению и взрыву при ударе. Ниж. КПВ в воздухе 26 мол. %. Вызывает ожоги кожи, слизистых оболочек и дыхат. путей; ПДК 1,4 мг/м3. Для стабилизации техн. H2O2 в него добавляют пирофосфат или станнат Na; при хранении в алюминиевых емкостях используют ингибитор коррозии — NH4NO3.
В. п. получен впервые Л. Тенаром в 1818 при действии H2SO4 на BaO2.
Мировое производство ок. 0,5 млн. т/год (1980).
Помимо H2O2 известны также высшие пероксиды водорода (полиоксиды водорода): H2O3 и H2O4 получают конденсацией при −195 °C плазмы тлеющего разряда в системах H2-O2, а также взаимод. атомов Н с жидким O3; H2O3 при −55 °C разлагается до H2O и O2, H2O4 при −100 °C-до H2O2 и O2.
Лит.: Шамб У., Сеттерфилд Ч., Вентворс Р., Перекись водорода, пер. с англ., М., 1958; Я год о век а я Т. В., Некрасов Л. И., "Ж. фнз. химии", 1977, т. 51, № 10, с. 2434–45; Weigert W. М. [u. a.], "Chemiker-Ztg.", 1975, Bd 99, N 3, S. 101–120; The chemistry of peroxides, ed. S. Patai, 1983, p. 1–96.
В. Л. Антоновский
Значения в других словарях
- ВОДОРОДА ПЕРОКСИД — ВОДОРОДА ПЕРОКСИД (перекись водорода) — Н2О2, бесцветная вязкая жидкость; плотность 1,45 г/см3, tпл = 0,41 °С, tкип = 150,2 °С. Легко разлагается на воду и кислород. Большой энциклопедический словарь
