водородная связь
ВОДОРОДНАЯ СВЯЗЬ
невалентное взаимод. между группой АН одной молекулы (RAH) и атомом В другой (BR'). В результате этого взаимод. образуется устойчивый комплекс RAH...BR' с межмолекулярной B.C., в котором атом водорода играет роль мостика, соединяющего фрагменты RA и BR'. B.C. возникает между электроотрицат. атомами А и В, гл. обр. О, N, F, реже Cl, S и некоторыми другими. Одним из признаков B.C. может служить расстояние между атомами Н и В во фрагменте А—Н...В. Если оно меньше суммы ван-дер-ваальсовых радиусов (см. атомные радиусы) атомов Н и В, то с большой вероятностью связь Н... В можно считать водородной. Если группа АН и атом В входят в состав одной и той же молекулы и расстояние между Н и В удовлетворяет тому же условию, то между ними возникает внутримолекулярная B.C., которая стабилизирует соответствующую конформацию молекулы.
Типичные В. с. возникают между молекулами RAH и BR', если они полярны. В соответствии с этим их взаимное притяжение, завершающееся образованием комплекса, обязано гл. обр. электростатич. силам. При этом протон слегка смещается в направлении к В; однако его равновесное расстояние от А, как правило, оказывается много короче расстояния до В. Тем не менее молекулу RAH условно наз. донором, a BR' — акцептером протона. Если в комплексе RAH...BR' происходит сильный сдвиг протона от А к В, завершающийся образованием ионов RA" и (HBR')+ , то молекулы RAH и BR' являются истинными донором и акцептором протона соответственно.
Как и для большинства др. видов межмол. взаимод. между полярными молекулами, в энергию B.C. главные вклады дают энергия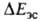 электростатич. притяжения недеформиров. фрагментов комплекса и энергия
электростатич. притяжения недеформиров. фрагментов комплекса и энергия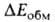 обменного отталкивания, начинающего действовать на близких расстояниях между фрагментами. В стабилизацию комплекса вносят также вклад (сравнительно небольшой) взаимная поляризация молекул (энергия
обменного отталкивания, начинающего действовать на близких расстояниях между фрагментами. В стабилизацию комплекса вносят также вклад (сравнительно небольшой) взаимная поляризация молекул (энергия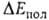 ) и их дисперсионное взаимодействие (энергия
) и их дисперсионное взаимодействие (энергия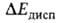 ). Энергия
). Энергия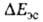 на больших расстояниях между фрагментами комплекса равна энергии притяжения их дипольных моментов. На близких расстояниях
на больших расстояниях между фрагментами комплекса равна энергии притяжения их дипольных моментов. На близких расстояниях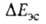 определяется как средняя энергия электронов и ядер одной из молекул, напр. RAH, в электростатич. потенциале другой. Т.к. атом Н в RAH заряжен положительно, он наиб. сильно притягивается к тем точкам молекулы BR', в которых ее потенциал наиб. отрицателен; эти точки обычно находятся в области локализации неподеленной электронной пары атома В. Поэтому молекула BR' часто ориентируется по отношению к RAH так, чтобы ось неподеленной пары приблизительно совпадала с направлением связи А—Н. В молекулах с ароматич. циклами, не имеющими гетероатомов с неподеленными электронами, потенциал наиб. отрицателен вблизи
определяется как средняя энергия электронов и ядер одной из молекул, напр. RAH, в электростатич. потенциале другой. Т.к. атом Н в RAH заряжен положительно, он наиб. сильно притягивается к тем точкам молекулы BR', в которых ее потенциал наиб. отрицателен; эти точки обычно находятся в области локализации неподеленной электронной пары атома В. Поэтому молекула BR' часто ориентируется по отношению к RAH так, чтобы ось неподеленной пары приблизительно совпадала с направлением связи А—Н. В молекулах с ароматич. циклами, не имеющими гетероатомов с неподеленными электронами, потенциал наиб. отрицателен вблизи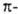 электронного облака, что и определяет в осн. геометрию комплекса с такими молекулами.
электронного облака, что и определяет в осн. геометрию комплекса с такими молекулами.
Энергия обменного отталкивания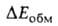 обязана тому, что в силу Паули принципа электроны с одинаковыми спинами "избегают" друг друга; это приводит к уменьшению электронной плотности в пространстве между ядрами двух сближающихся атомов Н и В в молекулах RAH и BR', вследствие чего эти ядра меньше экранируются электронами, чем в своб. атомах, и (будучи заряженными одноименно) при сближении начинают сильно отталкиваться один от другого. Энергия поляризации
обязана тому, что в силу Паули принципа электроны с одинаковыми спинами "избегают" друг друга; это приводит к уменьшению электронной плотности в пространстве между ядрами двух сближающихся атомов Н и В в молекулах RAH и BR', вследствие чего эти ядра меньше экранируются электронами, чем в своб. атомах, и (будучи заряженными одноименно) при сближении начинают сильно отталкиваться один от другого. Энергия поляризации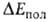 обязана в осн. деформации электронной оболочки каждой из молекул RAH и BR' в электростатич. поле другой. На больших расстояниях это приводит к появлению в каждой из них наведенного дипольного момента, который взаимодействует с постоянным дипольным моментом др. молекулы. На близких расстояниях поляризац. взаимод. не сводится к взаимод. диполей и имеет более сложную природу. В частности, помимо деформации электронной оболочки каждой из молекул как таковой происходит также частичный перенос электронной плотности с одной молекулы (BR') на другую (RAH). Однако относит, вклад этого эффекта в величину энергии
обязана в осн. деформации электронной оболочки каждой из молекул RAH и BR' в электростатич. поле другой. На больших расстояниях это приводит к появлению в каждой из них наведенного дипольного момента, который взаимодействует с постоянным дипольным моментом др. молекулы. На близких расстояниях поляризац. взаимод. не сводится к взаимод. диполей и имеет более сложную природу. В частности, помимо деформации электронной оболочки каждой из молекул как таковой происходит также частичный перенос электронной плотности с одной молекулы (BR') на другую (RAH). Однако относит, вклад этого эффекта в величину энергии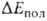 обычно мал. Он начинает играть роль только в очень сильных В. с., напр. в ионе (FHF) ~, в котором связи F—Н и Н—F эквивалентны.
обычно мал. Он начинает играть роль только в очень сильных В. с., напр. в ионе (FHF) ~, в котором связи F—Н и Н—F эквивалентны.
Дисперсионное взаимод. двух молекул обязано тому, что их электроны, в силу взаимного электростатич. отталкивания, двигаются так, чтобы в среднем находиться возможно дальше один от другого, что и снижает энергию системы. Абс. величина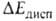 в B.C. обычно мала и вносит относительно заметный вклад только в очень слабые B.C., напр. комплексы молекул галогенводородов с атомами инертных газов, когда и др. вклады в энергию притяжения тоже малы. Суммарная энергия B.C. в таких комплексах
в B.C. обычно мала и вносит относительно заметный вклад только в очень слабые B.C., напр. комплексы молекул галогенводородов с атомами инертных газов, когда и др. вклады в энергию притяжения тоже малы. Суммарная энергия B.C. в таких комплексах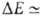
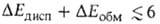 кДж/моль. Если обе молекулы RAH и BR' полярны, но их дипольные моменты малы, то В. с., хотя и упрочняется, остается слабой (
кДж/моль. Если обе молекулы RAH и BR' полярны, но их дипольные моменты малы, то В. с., хотя и упрочняется, остается слабой (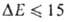 кДж/моль). При значит. полярности фрагментов комплекса образуются B.C. средней прочности (
кДж/моль). При значит. полярности фрагментов комплекса образуются B.C. средней прочности (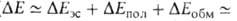 15–30 кДж/моль). Сильные B.C. в молекулярных (электрически нейтральных) комплексах имеют энергию до 60–80 кДж/моль, а в ионных до ~ 160 кДж/моль. Например, энергия распада комплекса (H2O*Н*OH2)+ на H2O и H3O+ в газовой фазе составляет 132 кДж/моль. Такое увеличение прочности В. с. обусловлено усилением электростатич. взаимод. и сильным перераспределением электронной плотности в обоих фрагментах.
15–30 кДж/моль). Сильные B.C. в молекулярных (электрически нейтральных) комплексах имеют энергию до 60–80 кДж/моль, а в ионных до ~ 160 кДж/моль. Например, энергия распада комплекса (H2O*Н*OH2)+ на H2O и H3O+ в газовой фазе составляет 132 кДж/моль. Такое увеличение прочности В. с. обусловлено усилением электростатич. взаимод. и сильным перераспределением электронной плотности в обоих фрагментах.
Группа АН может образовать тем более сильную B.C., чем выше положит. электростатич. потенциал вблизи атома Н. Поэтому наиб. прочные B.C. образуются в тех случаях, когда атом А и группы-заместители, входящие в молекулу RAH, наиб. электроотрицательны, а также когда молекула RAH способна сильно поляризоваться под влиянием BR'. Из галогенводородов самые прочные B.C. образует HF, из OH-кислот-HClO4, HNO3, RSO2OH, R2POOH, RCOOH. Фенолы, спирты и соед. с группой NH образуют менее сильные B.C. Среди NH-доноров наиб. сильные — HNCS, RNH(NO2), гетероциклич. соед. (типа пиразола, имидазола и др.), HN3, амиды, амины. Слабые доноры протона — соед. с SH-группой и такие CH-доноры, как HCN, СННа13, RC СН.
СН.
Способность атома В быть акцептором протона при образовании B.C. также определяется в осн. величиной электростатич. потенциала вблизи этого атома в молекуле BR'. наиб. прочные связи с данным донором протона образует атом О в оксидах аминов, арсинов, фосфинов, сульфидов; атом N в аминах. Слабее комплексы, образуемые атомом О карбонильной или алкоксильной группы; еще ниже протоноакцепторная способность атома О в группах NO2, SO2, атома N в группе С; ≡N, атома S в тионной и тио-эфирной группах,  электронов ароматич. систем и кратных связей. Слабые акцепторы протонов — атомы галогенов в алкилгалогенидах, причем это свойство уменьшается в ряду F, C1, Br, I. Рост электроотрицательности заместителей или включение своб. пары электронов атома В в сопряжение (как в атоме N амидов или ароматич. аминов) приводит к понижению его протоноакцепторной способности.
электронов ароматич. систем и кратных связей. Слабые акцепторы протонов — атомы галогенов в алкилгалогенидах, причем это свойство уменьшается в ряду F, C1, Br, I. Рост электроотрицательности заместителей или включение своб. пары электронов атома В в сопряжение (как в атоме N амидов или ароматич. аминов) приводит к понижению его протоноакцепторной способности.
Самые прочные B.C. характерны для ион-молекулярных комплексов типа (АНВ)-. Протоноакцепторная способность анионов растет в рядах I−, Вг−, Cl−, F− и ClO4−, NO3−, RCO2−, RO−.
Большинство молекул RAH, являющихся донорами протона, имеет и протоноакцепторные атомы, поэтому для межмол. B.C. характерна ассоциация молекул с образованием открытых или замкнутых в циклы цепей, а также разветвленных сетчатых структур. Спирты, фенолы, амины ассоциированы по типу
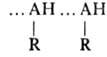
, амиды — по типу
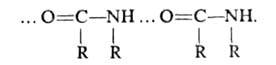
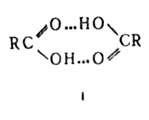
Карбоновые кислоты, лактамы образуют преим. циклич. димеры (формула 1). Трехмерную сетчатую структуру образует вода, каждая молекула которой может участвовать в образовании четырех B.C. С повышением температуры часть B.C. разрывается и степень ассоциации (относит. число ассоцииров. молекул) уменьшается. При комнатной температуре в газовой фазе и в инертных растворителях (алканы, CCl4) при концентрации порядка 10−4–10−5 моль/л сильно ассоциированы только карбоновые кислоты и HF. По мере увеличения числа заместителей и их электроотрицательности степень ассоциации уменьшается. Так происходит, напр., при замещении атомов Н на F в группе CH3 в спиртах: молекулы (CF3)3COH ассоциированы незначительно. Иногда способность молекул к ассоциации не реализуется вследствие стерич. затруднений; так, 2,6-ди-трет-бутилфенолы не ассоциированы. B.C., образуемые веществом в жидкой фазе, при кристаллизации обычно сохраняются (связи не разрываются). Кристаллич. структуры имеют вид цепей (напр., HF, метанол,  модификация щавелевой кислоты, PbHPO4) плоских двухмерных слоев (напр., формамид, борная кислота, α-модификация щавелевой кислоты), пространств. трехмерных сеток (лед, KH2PO4, L-глутаминовая кислота, ацетамид), спиральные структуры (белки, нуклеиновые кислоты). Взаимная ориентация фрагментов RAH и BR' в кристалле отличается от их расположения в газовой фазе или растворе, поскольку она должна обеспечивать миним. своб. энергию всей системы, а не только комплекса. Часто оптимальная с точки зрения прочности B.C. ориентация фрагментов реализуется в структуре с низким коэф. упаковки; пример — лед, который кристаллизуется в тетраэдрич. решетку с коэф. упаковки 0,4.
модификация щавелевой кислоты, PbHPO4) плоских двухмерных слоев (напр., формамид, борная кислота, α-модификация щавелевой кислоты), пространств. трехмерных сеток (лед, KH2PO4, L-глутаминовая кислота, ацетамид), спиральные структуры (белки, нуклеиновые кислоты). Взаимная ориентация фрагментов RAH и BR' в кристалле отличается от их расположения в газовой фазе или растворе, поскольку она должна обеспечивать миним. своб. энергию всей системы, а не только комплекса. Часто оптимальная с точки зрения прочности B.C. ориентация фрагментов реализуется в структуре с низким коэф. упаковки; пример — лед, который кристаллизуется в тетраэдрич. решетку с коэф. упаковки 0,4.
С наличием B.C. связан ряд особенностей вещества. Этим обусловлены кристаллич. структуры мн. молекулярных кристаллов (лед, спирты, борная кислота и др.), а также структуры белков, нуклеиновых кислот и др. биологически важных соед. Ассоциация молекул обусловливает высокие значения температур плавления и кипения, хорошую растворимость в воде, спиртах, амидах, высокую диэлектрич. проницаемость (напр., синильной кислоты, формамида), особенности спектральных характеристик. В частности, при образовании B.C. вместо узкой полосы, отвечающей колебаниям валентной связи А—Н, появляется широкая полоса, максимум которой сдвинут в сторону малых частот. Для очень сильных В. с. частота колебания АН снижается в 2–3 раза, а ширина и интегральная интенсивность полосы в ИК-спектре возрастают в 10–30 раз. Эти изменения позволяют судить об изменении межъядерного расстояния АН, а также о прочности B.C. В спектрах ЯМР образование B.C. приводит к изменению хим. сдвига мостикового протона, иногда и протонов смежных групп и ядер 13С, 17O, 14N, 15N, 19F в молекулах RAH и BR'. При очень сильных B.C. хим. сдвиг мостикового протона достигает 15–20 м. д.
мостикового протона, иногда и протонов смежных групп и ядер 13С, 17O, 14N, 15N, 19F в молекулах RAH и BR'. При очень сильных B.C. хим. сдвиг мостикового протона достигает 15–20 м. д.
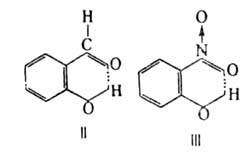
Внутримолекулярные B.C. образуются в спиртах, фенолах, первичных и вторичных аминах и др. соединениях, если в них присутствует вторая функц. группа, содержащая атомы О или N (см., напр., формулы II и III).
При этом возникает пяти-, шести- или семичленные циклы. В енолах и дикетонах стабилизация конформации В. с. осуществляется вследствие квазиароматич. характера образующегося цикла. В конформерах с внутримол. В. с. относит. ориентация донорной и акцепторной групп в большинстве случаев не соответствует той, которая реализуется при межмол. B.C.; иногда даже нарушаются характерные для последних соотношения между свойствами групп АН и В и величиной эффектов, обусловленных образованием связи АН...В.
дикетонах стабилизация конформации В. с. осуществляется вследствие квазиароматич. характера образующегося цикла. В конформерах с внутримол. В. с. относит. ориентация донорной и акцепторной групп в большинстве случаев не соответствует той, которая реализуется при межмол. B.C.; иногда даже нарушаются характерные для последних соотношения между свойствами групп АН и В и величиной эффектов, обусловленных образованием связи АН...В.
Если фрагменты молекулярного комплекса с B.C. имеют высокие кислотность и основность, возможен переход протона от донора к акцептору и образование ионной пары с B.c. A− ...НВ +. Этот процесс в значит. степени определяется взаимод. с окружением. Так, в газовой фазе CF3COOH, HCl, C6H5OH образуют с N(CH3)3 только молекулярные комплексы без перехода протона. Аминокислоты, напр. глицин и его производные, в газовой фазе и в инертных растворителях существуют в форме молекулярных комплексов, однако по мере усиления взаимод. с растворителем (в ряду алканы, ароматич. соед., хлоруглероды и др. дипольные растворители) образуются ионные пары с переходом протона. В ряде случаев в растворах наблюдается молекулярно-ионная таутомерия АН...В ⇄ А−...НВ+ (с понижением температуры равновесие смещается вправо). Образование ионных пар с В. с. непосредственно не связано с протонодонорной способностью молекулы RAH; переход протона наблюдается иногда даже от очень слабых CH-доноров, однако константа скорости перехода молекулярной формы комплекса в ионную возрастает при увеличении прочности В. с. в молекулярном комплексе. Отождествление типа комплекса возможно с помощью изучения спин-спинового взаимод. протона с соседними ядрами в спектрах ЯМР 1Н; этот метод позволяет идентифицировать центросимметричную структуру (А ... Н ... А)− или (В ... Н ...В)+. Присоединение второй молекулы донора протона к молекулярному комплексу может привести к тому, что по первой B.C. произойдет переход протона и образуется ионная пара, в которой анион связан B.C. с молекулой донора.
В соед. с внутримолекулярной В. с., в которых перемещение протона сопровождается перестройкой системы двойных связей, переход протона ведет к образованию таутомерной молекулярной структуры, как, напр., в хелатных енольных формах β-дикарбонильных соед. Взаимное превращ. двух таутомеров осуществляется быстро в шкале времени ЯМР; константа скорости перехода составляет 103 с−1.
В циклич. комплексах с B.C., в которых каждая молекула образует две В. с. с участием атома Н и неподеленной пары электронов атома функц. группы, происходит синхронное перемещение протонов по В. с. — вырожденный обмен между двумя эквивалентными состояниями комплекса. Этот процесс в газовой фазе и в малополярных апротонных растворителях определяет механизм реакции протонного обмена АН + ВН'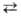 АН' + ВН (атомы А и В м. б. одинаковыми). Скорость вырожденного обмена растет с увеличением прочности B.C.; в циклич. димерах карбоновых кислот, комплексах кислот со спиртами константа скорости процесса превышает 105с−1 при 80 К. Протонный обмен спиртов с водой, кислотами, вторичными аминами в инертных растворителях или в газовой фазе изучают по скорости установления равновесного распределения изотопной метки или по форме сигналов спин-спинового взаимод. в спектрах ЯМР. Установлено, что реакция имеет первый порядок по каждому из компонентов, т. е. является бимолекулярной, константы скорости составляют 102–104 л/(моль∙с), энергия активации — от 4 до 20 кДж/моль. В случаях участия группы АН во внутримолекулярной B.C., включения неподеленной пары электронов в сопряжение (напр., в амидах, пирролах), снижения протонодонорной или протоноакцепторной способности фрагментов (напр., для тиолов, вторичных фосфи-нов) скорость обмена снижается, энергия активации реакции увеличивается. Синхронный переход протона в системах с невырожденным обменом иногда м. б. механизмом установления прототропных таутомерных равновесий.
АН' + ВН (атомы А и В м. б. одинаковыми). Скорость вырожденного обмена растет с увеличением прочности B.C.; в циклич. димерах карбоновых кислот, комплексах кислот со спиртами константа скорости процесса превышает 105с−1 при 80 К. Протонный обмен спиртов с водой, кислотами, вторичными аминами в инертных растворителях или в газовой фазе изучают по скорости установления равновесного распределения изотопной метки или по форме сигналов спин-спинового взаимод. в спектрах ЯМР. Установлено, что реакция имеет первый порядок по каждому из компонентов, т. е. является бимолекулярной, константы скорости составляют 102–104 л/(моль∙с), энергия активации — от 4 до 20 кДж/моль. В случаях участия группы АН во внутримолекулярной B.C., включения неподеленной пары электронов в сопряжение (напр., в амидах, пирролах), снижения протонодонорной или протоноакцепторной способности фрагментов (напр., для тиолов, вторичных фосфи-нов) скорость обмена снижается, энергия активации реакции увеличивается. Синхронный переход протона в системах с невырожденным обменом иногда м. б. механизмом установления прототропных таутомерных равновесий.
Образование В. с. и молекулярных комплексов в значит. степени определяет сольватацию ионов и электрич. проводимость растворов, поляризацию сегнетоэлектриков; обеспечивает механизм молекулярного распознавания при самосборке биол. структур, напр. синтез РНК с использованием в качестве матрицы ДНК при трансляции, структурное соответствие молекул нуклеиновых кислот или их участков (см. комплементарность). Роль В. с. существенна во мн. процессах хим. технологии, в частности при адсорбции, экстракции, кислотно-основном катализе.
Лит.: Водородная связь, М., 1981; Пиментел Дж., Мак-Клеллан О., Водородная связь, пер. с англ., М., 1964; Joesten M.D.. SchaadL.I., Hydrogen bonding, N.Y., 1974; The hydrogen bond: recent developments in theory and experiments, ed. P. Shuster [a.o.], v. 1–3, Amst., 1976; Geiseler G., Seidel H., Die Wasserstoffbriickenbindung, В., 1977.
Г. С. Денисов, Н. Д. Соколов
Значения в других словарях
- ВОДОРОДНАЯ СВЯЗЬ — Тип связи, промежуточный между ковалентной химической связью и невалентным межат. вз-ствием и осуществляющийся с участием атома водорода, расположенного либо между молекулами, либо между атомами внутри молекулы. Примером межмолекулярной В. с. явл. Физический энциклопедический словарь
- Водородная связь — Вид химического взаимодействия атомов в молекулах, отличающийся тем, что существенное участие в нём принимает атом водорода (Н), уже связанный ковалентной связью с другим атомом (А). Большая советская энциклопедия
- ВОДОРОДНАЯ СВЯЗЬ — ВОДОРОДНАЯ СВЯЗЬ, ХИМИЧЕСКАЯ связь, образующаяся между некоторыми молекулами, содержащими водород. Атом водорода должен быть связан с электроотрицательным (отталкивающим электроны) атомом... Научно-технический словарь
- ВОДОРОДНАЯ СВЯЗЬ — ВОДОРОДНАЯ СВЯЗЬ — вид химической связи типа А — Н... А'; образуется в результате взаимодействия атома водорода, связанного ковалентной связью с электроотрицательным атомом А (N, O, S и др. Большой энциклопедический словарь
