вольфрам
ВОЛЬФРАМ [от нем. Wolf — волк, Rahm — сливки ("волчья пена" — назв. дано в 16 в., т. к. мешал выплавке олова, переводя его в шлак); лат. Wolframium] W
хим. элемент VI гр. периодической системы, ат. н. 74, ат. м. 183,85. Прир. В. состоит из пяти стабильных изотопов с мас. ч. 180 (0,135%), 182 (26,41%), 183 (14,4%), 184 (30,64%) и 186 (28,41%). Поперечное сечение захвата тепловых нейтронов 19,2∙10−28 м2. Конфигурация внеш. электронной оболочки 5d46s2; степени окисления +2; +3, +4, +5, +6 (наиб. характерна); энергия ионизации W° → W+ → W2+ соотв. 770 и 1710 кДж/моль; электроотрицательность по Полингу 1,7; сродство к электрону 0,5 эВ; работа выхода электронов 4,55 эВ; электронная эмиссия (мА/см2): 1,5∙10−10 (1100 К), 2,3∙10−1 (1900 К), 298 (2500 К); ат. радиус 0,1368 нм; ионные радиусы (в скобках указаны координац. числа) W4+ 0,080 нм (6), W6+ 0,065 нм (4), 0,074 нм (6).
В. мало распространен в природе. Содержание в земной коре 1∙10−4 % по массе. Известно ок. 15 собств. минералов, большинство из них — вольфраматы. Наиб. важные минералы — вольфрамит (Fe, Mn)WO4 [его разновидности — ферберит (Fe → Mn > 4 :1) и гюбнерит (Mn → Fe > 4 :1)] и шеелит CaWO4. Наиб. крупные пром. месторождения в КНР, СССР, КНДР, Южной Корее, США, Таиланде, Канаде, Боливии, Австралии, Бразилии, Португалии. Мировые запасы В. в рудах 1815 тыс. т (1976).
Свойства. В. — металл светло-серого цвета. Осн. устойчивая модификация- α-W, решетка объемноцентриров. кубическая (а = 0,31589 нм, z = 2, пространственная группа Im3m). Существует также β-модификация с кубич. кристаллической решеткой (z = 8, пространственная группа Рт3п); образуется при восстановлении тонкого слоя WO3 сухим H2 при 440–630 °C; выше 630 °C необратимо превращ. в α-W. В. — самый тугоплавкий металл, т. пл. 3380±10 °C, т. кип. 5900–6000 °C; плотн. 19,3 г/см3, жидкого 16,65 г/см3; C0 24,27 Дж/(моль∙К); 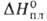 46 кДж/моль,
46 кДж/моль, 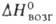 850 кДж/моль (О К); S0298 32,6 Дж/(моль∙К); уравнение температурной зависимости давления пара над твердым В. в интервале 2000–3500 К: lg р (мм рт. ст.) = 42000/Г + 9,84 -— 0,146T-lg Т — 0,164∙10−3T; скорость испарения [в г/(см2*с)1 2,18∙10−12 (2200 К), 1,06∙10−6 (3000 К), 2,06∙10−5 (3273 К); температурный коэф. линейного расширения (К−1): 4,1∙10−6 (298 К), 6,5∙10−6 (2273 К), 7,1∙10−6 (2673 К); теплопроводность [Вт/(м∙К)]: 153 (298 К), 105 (1873 К); температуропроводность (м2/с): 3,17∙103 (1873 К), 2,3∙103 (2873 К); излучательная способность (Вт/см2): 23,65 (2200 К), 112,5 (2800 К), 203 (3200 К);
850 кДж/моль (О К); S0298 32,6 Дж/(моль∙К); уравнение температурной зависимости давления пара над твердым В. в интервале 2000–3500 К: lg р (мм рт. ст.) = 42000/Г + 9,84 -— 0,146T-lg Т — 0,164∙10−3T; скорость испарения [в г/(см2*с)1 2,18∙10−12 (2200 К), 1,06∙10−6 (3000 К), 2,06∙10−5 (3273 К); температурный коэф. линейного расширения (К−1): 4,1∙10−6 (298 К), 6,5∙10−6 (2273 К), 7,1∙10−6 (2673 К); теплопроводность [Вт/(м∙К)]: 153 (298 К), 105 (1873 К); температуропроводность (м2/с): 3,17∙103 (1873 К), 2,3∙103 (2873 К); излучательная способность (Вт/см2): 23,65 (2200 К), 112,5 (2800 К), 203 (3200 К); 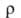 (Ом∙м): 5,5∙10−8 (298 К), 55,7∙10−8 (2000 К), 108,5∙10−8 (2500 К); температурный коэф.
(Ом∙м): 5,5∙10−8 (298 К), 55,7∙10−8 (2000 К), 108,5∙10−8 (2500 К); температурный коэф.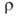 5,0∙10−3 К −1 (273 — 473 К); температура перехода в сверхпроводящее состояние 0,0160 К. В. парамагнитен, магн. восприимчивость 0,32∙10−9. Мех. свойства В. сильно зависят от способа его получения, чистоты и предшествующей мех. и термич. обработки. Техн. В. хрупок при нормальной температуре, при 200–500 °C переходит в пластичное состояние; высокочистыи монокристаллич. В. пластичен вплоть до −196 °C. Твердость по Бринеллю для спеченного штабика 2000–2300 МПа, для листа толщ. 2 мм 3500–4000 МПа; для проволоки модуль упругости 380–410 ГПа (298 К); в зависимости от диаметра
5,0∙10−3 К −1 (273 — 473 К); температура перехода в сверхпроводящее состояние 0,0160 К. В. парамагнитен, магн. восприимчивость 0,32∙10−9. Мех. свойства В. сильно зависят от способа его получения, чистоты и предшествующей мех. и термич. обработки. Техн. В. хрупок при нормальной температуре, при 200–500 °C переходит в пластичное состояние; высокочистыи монокристаллич. В. пластичен вплоть до −196 °C. Твердость по Бринеллю для спеченного штабика 2000–2300 МПа, для листа толщ. 2 мм 3500–4000 МПа; для проволоки модуль упругости 380–410 ГПа (298 К); в зависимости от диаметра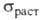 для неотожженной проволоки 1800–4150 МПа, для отожженной 900–1300 МПа. Коэф. сжимаемости В. ниже, чем у всех металлов. По длительности сохранения прочности при 800–1300 °C он значительно превосходит Mo, Та и Nb. Компактный В. устойчив на воздухе, при 400 °C начинает окисляться, выше 500 °C быстро окисляется до триоксида WO3 (см. вольфрама оксиды). С холодной и горячей водой не взаимод., парами воды выше 600 °C окисляется до WO3, WO2 и др. оксидов. На холоду устойчив к действию соляной кислоты, H2SO4, HNO3, а также смеси HNO3 и H2SO4, активно взаимод. со смесью кислот HNO3 и HF, медленно — с H2O2. При 90–100 °C устойчив к действию фтористоводородной кислоты, слабо взаимод. с соляной кислотой, H2SO4 и H2CrO4, несколько сильней — с HNO3 и царской водкой. Не взаимод. с растворами щелочей и NH3 на холоду, слабо реагирует с ними при нагр. в присутствии O2. Быстро окисляется в расплавленном NaOH или KOH при доступе воздуха или в присутствии окислителей (NaNO3, NaNO2 и др.) с образованием вольфраматов.
для неотожженной проволоки 1800–4150 МПа, для отожженной 900–1300 МПа. Коэф. сжимаемости В. ниже, чем у всех металлов. По длительности сохранения прочности при 800–1300 °C он значительно превосходит Mo, Та и Nb. Компактный В. устойчив на воздухе, при 400 °C начинает окисляться, выше 500 °C быстро окисляется до триоксида WO3 (см. вольфрама оксиды). С холодной и горячей водой не взаимод., парами воды выше 600 °C окисляется до WO3, WO2 и др. оксидов. На холоду устойчив к действию соляной кислоты, H2SO4, HNO3, а также смеси HNO3 и H2SO4, активно взаимод. со смесью кислот HNO3 и HF, медленно — с H2O2. При 90–100 °C устойчив к действию фтористоводородной кислоты, слабо взаимод. с соляной кислотой, H2SO4 и H2CrO4, несколько сильней — с HNO3 и царской водкой. Не взаимод. с растворами щелочей и NH3 на холоду, слабо реагирует с ними при нагр. в присутствии O2. Быстро окисляется в расплавленном NaOH или KOH при доступе воздуха или в присутствии окислителей (NaNO3, NaNO2 и др.) с образованием вольфраматов.
С азотом В. реагирует выше 1500 °C; при 2300–2500 °C образуется нитрид WN2, который в отсутствии N2 разлагается выше 800 °C. Водород не реагирует с В. вплоть до температуры плавления. В В. мало растворимы O2 (менее 10−4% по массе), N2 (~ 10−5%) и H2 (менее 10−4%), с F2 выше 150 °C В. образует фториды (см. вольфрама гексафторид), с Cl2 выше 800 °C — хлориды, с Br2 и I2 при 600–700 °C — соотв. бромиды и иодиды (см. вольфрама галогениды).
С парами S и Se, а также с H2S и H2Se выше 400 °C образует соотв. дисульфид WS2 (см. вольфрама сульфиды) и диселенид WSe2, с кремнием и бором выше 1400 °C — соотв. силициды (WSi2 и W5Si3) и бориды (W2B, WB, W2B5 и др.). При 700–800 °C SO2 окисляет В. до оксидов, CO2 выше 1200 °C — до WO2, оксиды N выше 600 °C — до WO3. Взаимод. В. с углеводородами при 1100–1200 °C приводит к карбидам. До ~ 1400 °C В. устойчив в атмосфере CO, при более высокой температуре образуются вольфрама карбиды. При 200–300 °C и давлении CO 20 МПа В. (в возбужденном состоянии) образует с CO гексакарбонил W (CO)6 — бесцветные кристаллы; т. пл. 169 °C, т. кип. 175 °C; не раств. в воде; выше 350 °C разлагается на W и СО; применяют как катализатор полимеризации олефинов, для нанесения вольфрамовых покрытий на металлы, керамику, графит, для синтеза воль-фраморг. соед. (см. также карбонилы металлов).
В. очень медленно взаимод. с Hg, Na, К, Ga, Mg даже при 600 °C. Он устойчив при 600 °C в сплаве Вуда (см. свинца сплавы), при 1000 °C — в эвтектич. сплаве Na-K, до 1680 °C не реагирует с расплавленными Bi, Ca, Cu и Sn. При 1100 °C В. медленно раств. в U, выше 700 °C реагирует с жидким А1, давая интерметаллиды. В. способен образовывать сплавы со мн. металлами (см. вольфрама сплавы).
Важнейшие кислородные соед. B. — WO3, вольфрамовая кислота WO3*H2O и ее соли (вольфраматы). Известны поливольфраматы — соли высокомол. изополи- и акваполикислот, а также гетерополивольфраматы — соли гетерополивольфрамовых кислот (см. гетерополисоединения). При восстановлении вольфраматов щелочных металлов получают вольфрамовые бронзы-кристаллич. вещества с металлич. свойствами (см. бронзы оксидные).
Диселенид вольфрама WSe2 — темно-серые кристаллы с гексагон. решеткой (а = 0,3280 нм, с=1,2950нм, пространственная группа p63/mmc); выше 550 °C окисляется на воздухе до WO3; в вакууме выше 900 °C диссоциирует на W и Se. Не раств. в воде; не взаимод. с разб. HCl, H2SO4, растворами щелочей. Окисляется HNO3. Получают взаимод. паров Se или H2Se с W или WO3 при 600–800 °C. Полупроводник р-типа; используется как твердая смазка.
Дисилицид вольфрама WSi2 — голубовато-серые кристаллы с тетрагон. решеткой (а = 0,3212 нм, с = = 0,7880 нм, z = 2, пространств. ггруппа I4/mmm); т. пл. 2165 °C; плотн. 9,25 г/см3; 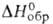 −93,7 кДж/моль;
−93,7 кДж/моль; 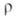 12,5∙10−8 Ом∙м;
12,5∙10−8 Ом∙м; 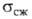 1269 МПа (20 °C); микротвердость 10740 МПа (нагрузка 50 г). Не раств. в воде; не взаимод. с неорг. кислотами (кроме фтористоводородной кислоты). Получают: взаимод. паров Si с W в вакууме при 1150–1350 °C; восстановлением SiCl4 водородом на нагретой до 1100–1800 °C поверхности W; по реакции 4SiCl2 + W
1269 МПа (20 °C); микротвердость 10740 МПа (нагрузка 50 г). Не раств. в воде; не взаимод. с неорг. кислотами (кроме фтористоводородной кислоты). Получают: взаимод. паров Si с W в вакууме при 1150–1350 °C; восстановлением SiCl4 водородом на нагретой до 1100–1800 °C поверхности W; по реакции 4SiCl2 + W WSi2 + 2SiCl4. Образует на изделиях из В. защитные покрытия, устойчивые на воздухе до 2000 °C.
WSi2 + 2SiCl4. Образует на изделиях из В. защитные покрытия, устойчивые на воздухе до 2000 °C.
Борид вольфрама (пентаборид дивольфрама) W2B5 — серые кристаллы с металлич. блеском, решетка гексагональная (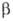 =W2B5; а = 0,292нм, с=1,387нм, пространственная группа С6/mmc); т. пл. 2300 °C (с разл.); плотн. 13,0 г/см3; микротвердость 25800 МПа; на воздухе выше 800 °C окисляется. Не раств. в воде. Разлагается царской водкой, а также HNO3 и конц. H2SO4 при кипячении. Получают взаимод. WO3 с В4С и С в вакууме при 1150–1300 °C. Компонент твердых сплавов для режущих инструментов, наплавочных износостойких материалов для стали и чугуна; образует защитные покрытия на В.
=W2B5; а = 0,292нм, с=1,387нм, пространственная группа С6/mmc); т. пл. 2300 °C (с разл.); плотн. 13,0 г/см3; микротвердость 25800 МПа; на воздухе выше 800 °C окисляется. Не раств. в воде. Разлагается царской водкой, а также HNO3 и конц. H2SO4 при кипячении. Получают взаимод. WO3 с В4С и С в вакууме при 1150–1300 °C. Компонент твердых сплавов для режущих инструментов, наплавочных износостойких материалов для стали и чугуна; образует защитные покрытия на В.
Получение. Вольфрамовые руды (содержат 0,15–0,5% WO3) обогащают гравитационными методами, флотацией, магн. и электростатич. сепарацией, а также хим. способами. Для получения В. и его соед. используют рудные концентраты, содержащие 55–65% WO3, иногда 10–20%, направляемые на хим. переработку. Пром. способы извлечения В. из рудных концентратов подразделяют на щелочные (наиболее распространенные) и кислотные. В первом случае вольфрамитовый или шеелитовый концентрат разлагают спеканием с Na2CO3 при 800–900 °C с послед. выщелачиванием спека водой или обработкой раствором Na2CO3 в автоклаве при 200–225 °C Вольфрамитовые концентраты иногда разлагают нагреванием с растворами NaOH. Для полного разложения вольфрамита спеканием требуется небольшой избыток Na2CO3 по сравнению со стехиометрически необходимым количеством; в случае шеелита в шихту добавляют SiO2 (2CaWO4 + 2Na2CO3 + SiO2 → 2Na2WO4 + Ca2SiO4 + 2CO2). Для полного разложения в автоклаве шеелитовых концентратов избыток Na2CO3 должен составлять 250–300%, а в случае вольфрамитовых концентратов — 300–400%. Из образовавшихся водных растворов Na2WO4 после их очистки от примесей (Si, P, As, Mo, F) действием CaCl2 или Ca(NO3)2 осаждают CaWO4, который затем разлагают соляной кислотой или HNO3 и выделяют вольфрамовую кислоту. Последнюю прокаливают, получая WO3, или растворяют в водном растворе NH3, из которого выпариванием кристаллизуют паравольфрамат (NH4)10[H2W12O42]*4H2O. Это соед. м. б. также получено более простым способом — экстракцией водными растворами солей аминов или четвертичных аммониевых соед. (при pH 2,5–3) с послед. реэкстракцией растворами NH3. Перспективен метод его получения из растворов Na2WO4 с использованием ионообменных смол.
По кислотному способу шеелитовые концентраты (с содержанием WO3 65–75%) разлагают кислотами (HCl, HNO3); образующуюся при этом вольфрамовую кислоту раств. в водном растворе NH3 и затем кристаллизуют в виде паравольфрамата аммония.
Осн. продукты переработки вольфрамовых концентратов — WO3 (получаемый термич. разложением W03-H20 или (NH4)10[H2W12042]*4H20) и ферровольфрам [сплав W (65–80%) и Fe (35–20%), выплавляемый для нужд черной металлургии]. Восстановлением WO3 водородом при 700–900 °C в многотрубных или вращающихся трубчатых печах получают В. в виде порошка разл. гранулометрич. состава (наиб. типичны порошки со средним размером частиц 2–3 мкм). Осн. примесь в порошках — кислород (0,05–0,3%). Получают также порошки В. с присадками оксидов Th, La, Y, A1, а также K2SiO3, которые вводят в WO3 перед его восстановлением.
Компактный металл получают преим. методами порошковой металлургии. Заготовки сечением от 10*10 до 20*20 мм и длиной 500–600 мм (штабики) прессуют под давл. 150–500 МПа и подвергают спеканию в две стадии: первая (упрочнение штабика) проводится при 1150–1300 °C в атмосфере H2, вторая (сварка)-прямым пропусканием электрич. тока при 2900–3000 °C. Плотность штабиков после спекания 17,5–18,5 г/см3. Изделия из них (проволока, лента и др.) изготовляют обработкой давлением при температурах ниже температуры рекристаллизации В. По мере обработки температура понижается от 1300–1400 °C (при ковке) до 800–500 °C (при волочении или прокатке). В результате волочения через твердосплавные, а затем алмазные фильеры получают вольфрамовую проволоку диаметром 10–300 мкм.
Крупные заготовки (до 300 кг) производят методом гидростатич. прессования порошков, помещенных в эластичные оболочки. Такие заготовки спекают в индукционных печах в вакууме или в атмосфере H2 при 2400–2500 °C. Для получения компактных заготовок используют также дуговую вакуумную плавку или гарнисажную дуговую с разливом металла в изложницу.
В огранич. масштабах В. получают восстановлением его гексагалогенидов, гл. обр. WF6, водородом. При проведении процесса в газовой фазе в потоке получают высокодисперсные порошки, в кипящем слое — крупные сферич. гранулы размером 200–500 мкм. Последние превращают в компактные заготовки горячим газостатич. прессованием. Способ получения изделий восстановлением WF6 (получивший название газофазное формование) заключается в осаждении В. из газовой фазы в виде плотного покрытия на нагретых до 600–700 °C подложках из др. металлов или графита. Методом бестигельной зонной плавки спеченных штабиков получают монокристаллы В., отличающиеся высокой чистотой и пластичностью.
Определение. Качественно В. определяют: по выделению белого аморфного осадка WO3*nH2O при добавлении HCl или H2SO4 в раствор образца; по образованию вольфрамовой сини при добавлении SnCl2 в кислый раствор образца; по желто-зеленой окраске раствора в присутствии роданид-иона и восстановителя (напр., SnCl2) и др. методами. При большом содержании в анализируемом образце (концентраты, ферровольфрам и др.) В. определяют гравиметрически в виде WO3 (образуется после прокаливания вольфрамовой кислоты или осадков, выделяющихся при действии, напр., цинхонина, бензндина и др.), а также потенциометрич. титрованием солью Cr+ в кислой среде. При низком содержании В. определяют преим. фотометрически по реакции с роданид-ионами в присутствии TiCl3. Для перевода В. в раствор исходную навеску разлагают соляной или азотной кислотой, осадок WO3*nH2O раств. в водном растворе NH3; иногда используют выщелачивание содового плава водой.
Применение. До 50% получаемого В. используют в производстве легированных (гл. обр. инструментальных) сталей, важнейшие из которых — быстрорежущие, содержащие 8–20% В. Примерно 35–45% В. расходуется на производство твердых сплавов на основе карбида WC (85–95% WC и 5–15% Со). Некоторые сплавы, кроме WC, содержат TiC, ТаС и NbC. Эти сплавы применяют для изготовления рабочих частей режущих и буровых инструментов, фильер для протяжки проволоки и др. В виде сплавов с др. металлами В. используют в авиац. и ракетной технике, электротехнике; чистый В. — для изготовления спиралей и нитей накаливания в производстве электроламп, в электровакуумной технике для изготовления катодов, рентгеновских трубок, сеток, подогревателей катодов, выпрямителей высокого напряжения и др.
Искусственные радиоактивные изотопы В. 181W (T1/2 120сут), 185W (T1/2 78,5 сут) и 187W (T1/2 24 ч) - изотопные индикаторы.
Производство вольфрамовых концентратов (65% WO3) в капиталистич. странах 39400 т/год (1978), в т. ч. в США 6300, Таиланде 6200, Боливии 6100, Южной Корее 5000, Австралии 5300, Канаде 4400, Бразилии 2200, Португалии 2100 т/год.
В. открыт в виде WO3 К. Шееле в 1781. Металлич. В. впервые получили X. X. и Ф. д'Элуяры в 1873. В Великобритании, США и Франции употребляется первоначальное название В. — "тангстен" (тунгстен, швед. tungsten, букв. — тяжелый камень).
Лит.: Зеликман А. Н., Крейн О. Е., Самсонов Г. В., Металлургия редких металлов, 3 изд., М., 1978; Зеликман А. Н., Никитина Л. С, Вольфрам, М., 1978; Rollinson С. Pergamon textes in inorganic chemistry, v. 21-The chemistry of Cr, Mo and W, Oxf.-[a.o.]. 1973; YihS.W.H., WangC.T., Tungsten, N. Y., 1978; Gmelins Handbuch der anorganischen Chemie. Wolfram, Bd A. 1, Technologic des Metals, В., 1979.
А. Н. Зеликман
Значения в других словарях
- Вольфрам — (лат. Wolframium) W, химический элемент VI группы периодической системы Менделеева, порядковый номер 74, атомная масса 183,85; тугоплавкий тяжёлый металл светло-серого цвета. Природный... Большая советская энциклопедия
- вольфрам — орф. вольфрам, -а Орфографический словарь Лопатина
- вольфрам — Вольфра́м/. Морфемно-орфографический словарь
- вольфрам — Заимств. в XVIII в. из нем. яз. Сложение Wolf «волк» (ср. название этого минерала русскими — волчец) и Rahm «грязь». Вольфрам вначале считался шлаком. Этимологический словарь Шанского
- ВОЛЬФРАМ — ВОЛЬФРАМ (символ W), светло-серый ПЕРЕХОДНОЙ ЭЛЕМЕНТ. Впервые выделен в 1783 г. Основные источники — руды ВОЛЬФРАМИТ и ШЕЕЛИТ. Имеет самую высокую температуру плавления из всех металлов. Применяется в лампах накаливания и в специальных сплавах. Научно-технический словарь
- Вольфрам — W (лат. Wolframium; * a. tungsten; н. Wolfram; ф. tungstene; и. tungsteno), — хим. элемент VI группы периодич. системы Mенделеева, ат.н. 74, ат. м. 183,85. Природный B. Горная энциклопедия
- вольфрам — ВОЛЬФРАМ -а; м. [нем. Wolfram] Химический элемент (W), тугоплавкий металл серебристо-белого цвета; применяется в металлургии, электротехнике (нити накаливания в электролампах), радиоэлектронике. ◁ Вольфрамовый, -ая, -ое. В-ая соль. В-ая сталь. Толковый словарь Кузнецова
- вольфрам — ВОЛЬФРАМ м. металл волчец. Толковый словарь Даля
- вольфрам — ВОЛЬФРАМ, а, м. Химический элемент, тугоплавкий металл серебристого цвета. | прил. вольфрамовый, ая, ое. Вольфрамовая руда. Толковый словарь Ожегова
- вольфрам — [< соб. нем.] – хим. элемент, символ W, порядковый номер 74, атомный вес 183,92; тяжёлый тугоплавкий твёрдый блестящий металл серо-стального цвета; применяется при изготовлении инструментальной и магнитной стали, нитей для электрических лампочек накаливания, а также для производства красок Большой словарь иностранных слов
- вольфрам — ВОЛЬФР’АМ, вольфрама, ·муж. (·иностр.) (·хим. ). Название твердого тугоплавкого металла. Толковый словарь Ушакова
- вольфрам — Заимствование из нем. яз., где оно является сложением Wolf – "волк" и Rahm – "сливки", что можно было бы перевести как "волчья пена". Такое пренебрежительное название связано с тем, что вольфрам вначале считался шлаком. Кстати, исконно русское название минерала – волчец. Этимологический словарь Крылова
- вольфрам — вольфрам м. Химический элемент, тугоплавкий металл светло-серого цвета, применяемый в различных сплавах, при изготовлении нитей накаливания в электрических лампочках, а также при производстве красок. Толковый словарь Ефремовой
- ВОЛЬФРАМ — ВОЛЬФРАМ (лат. Wolframium) — W, химический элемент VI группы периодической системы, атомный номер 74, атомная масса 183,85. Название от немецкого Wolf — волк и Rahm — сливки ("волчья пена"). Большой энциклопедический словарь
