железа фосфаты
ЖЕЛЕЗА ФОСФАТЫ
Ортофосфат Fe(II) (в природе — минерал графтонит) Fe3(PO4)2 — кристаллы (см. табл.); получают осаждением из водных растворов FeSO4 фосфатом Na при 60–80 °C с послед. обезвоживанием образующихся кристаллогидратов. Кристаллизуется из водных растворов в форме октагидрата Fe3(PO4)2.8H2O (в природе — минерал вивианит), который при нагр. превращ. в тетрагидрат Fe3(PO4)2.4H2O; полностью обезвоживается при 180 °C. Известны кислые фосфаты железа(II) — FeHPO4.nH2O, где n = 1,2, а также фосфаты Fe3IIFeIII(PO4)3 и конденсированные состава Fe(PO4)2. Все фосфаты Fe(II) при нагр. легко окисляются O2 воздуха до фосфатов Fe(III); в воде не раств., раств. в минер. кислотах.
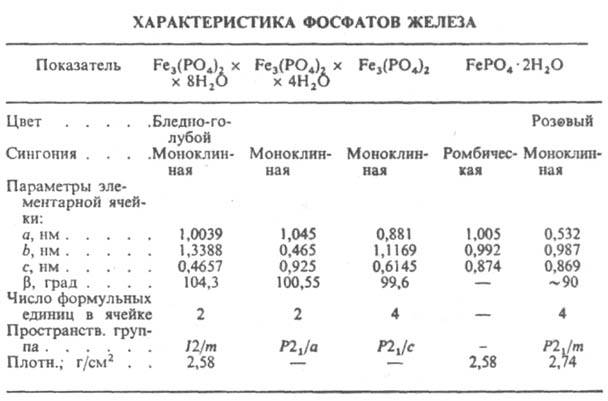
Ортофосфат железа (III) FePO4 — желтые кристаллы; низкотемпературная модификация при 600 °C переходит в гексагональную (а = 0,504 нм, с — 0,562 нм), выше 950 °C — в ромбическую типа штренгита; ΔH0обр −1287,8 кДж/моль; не раств. в воде, раств. в соляной и серной кислотах. Кристаллизуется из водных растворов в виде дигидрата FePO4.2H2O, который обезвоживается выше 250 °C; в природе — минералы штренгит (ромбический) и меташтренгит (моноклинный). Получают взаимод. NaH2PO4 с раствором соли Fe(III). Образуется как защитное покрытие при фосфатировании стали и чугуна. Кислый фосфат Fe(III) имеет состав Fe(H2PO4)3.2H2O. Известны конденсированные фосфаты железа(Ш) -FeH2P3O10.nH2O, где п = 0,1,2, а также линейные и циклические состава Fe(PO3)3, в которых анион представляет собой циклы Р4O124− или Р6O186− либо имеет линейное цепочечное строение (PO3):. Циклич. полифосфаты при ~ 1000 °C превращаются в линейные, которые плавятся при 1250 °C с частичной потерей P2O5, а при дальнейшем нагревании при 1300–1400 °C дают смесь Fe4(P2O7)3 и линейного Fe(PO3)3. Известны двойные ди- и тетрациклофосфаты соотв. M1FeP2O7 и M1Fe(PO3)4, где М1 — щелочной металл.
Лит.: Корбридж Д., Фосфор. Основы химии, биохимии, технологии, пер. с англ.. М., 1982, с 139–40; Лепилина Р. Г. , Смирнова Н. М., Термограммы неорганических фосфатных соединений. Справочник, Л., 1984, с. 286 88; Comprehensive inorganic chemisty, ed. by J. C. Bailar, A. F Trotman Dickenson, v. 1, Oxf. N. Y. Toronto, 1973, p. 1041
Л. Н. Комиссарова., П. П. Мельников
