жесткость воды
ЖЕСТКОСТЬ ВОДЫ
совокупность свойств воды, обусловленная наличием в ней преим. катионов Ca2+ (кальциевая Ж. в.) и Mg2+ (магниевая Ж. в.). Один из возможных их источников — горные породы (известняки, доломиты), которые растворяются в результате контакта с прир. водой. Сумма концентраций Ca2+ и Mg2+ наз. общей Ж. в. Она складывается из карбонатной (временной, устраняется кипячением) и некарбонатной (постоянной) Ж. в. Первая вызвана присутствием в воде гидрокарбонатов Ca и Mg [при кипячении разлагаются на CaCO3 и Mg(OH)2 с выделением CO2], вторая — наличием сульфатов, хлоридов, силикатов, нитратов и фосфатов этих металлов. В СССР Ж. в. выражают в ммоль экв/л: карбонатная жесткость отвечает той части катионов Ca2+ и Mg2+, которая эквивалентна содержащимся в воде анионам НCO3−, некарбонатная — анионам SO42−, NO3− и др. (1 ммоль экв/л соответствует 20,04 мг/л катионов Ca2+ или 12,16 мг/л катионов Mg2+). В др. странах для выражения Ж в. часто используют т. наз. градусы жесткости. Например, Г жесткости немецкий, соответствующий 0,01 г CaO в 1 л воды, равен 0,357 ммоль экв/л. Ж. в. обычно определяют титрованием раствором дигидрата динатриевой соли этилендиаминтетрауксусной кислоты (комплексон III, трилон Б) в щелочной среде. При титровании с использованием комплексонометрич. индикаторов находят: в присутствии эриохрома черного Т (хромогеновый черный ЕТ) — общую Ж. в. (Жоб), в присутствии мурексида (пурпурат аммония) — кальциевую Ж. в. (ЖСа ). Магниевую Ж. в. определяют из выражения: ЖMg = Жоб — ЖCa. Если содержание катионов Ca2+ и Mg2+ в воде было найдено др. методами, общую Ж. в. можно вычислить по формуле:
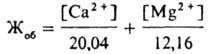
Ж. в. колеблется в широких пределах: от 0,1–0,2 ммоль экв/л в реках и озерах, расположенных в зонах тайги и тундры, до 80–100 ммоль экв/л и более в подземных водах, морях и океанах. Различают воду мягкую (общая жесткость до 2 ммоль экв/л), средней жесткости (2–10 ммоль экв/л) и жесткую (более 10 ммоль экв/л). В поверхностных водоисточниках, где преобладает, как правило, карбонатная жесткость (70–80% от общей), а магниевая жесткость обычно не превышает 30%, реже 60% от общей, наиб. значения Ж. в. достигает в конце зимы, наименьшего — в период паводка. Так, в Волге (г. Горький) макс. Ж. в. бывает в марте (4,3 ммоль экв/л), минимальная — в мае (0,5 ммоль экв/л). В подземных водах Ж. в. более постоянна и меньше изменяется в течение года. Повыш. Ж. в. способствует усиленному образованию накипи в паровых котлах, отопит. приборах и бытовой метал-лич. посуде, что значительно снижает интенсивность теплообмена, приводит к большому перерасходу топлива и перегреву металлических поверхностей. Ж. в. увеличивает расход мыла при стирке, поскольку часть его образует с катионами Ca2+ нерастворимый осадок. Качество тканей, стираемых в жесткой воде, и тканей, при отделке которых она применяется, ухудшается вследствие осаждения на тканях кальциевых и магниевых солей высших жирных кислот мыла. В воде с высокой жесткостью плохо развариваются овощи и мясо, т. к. катионы Ca2+ образуют с белками пищ. продуктов нерастворимые соединения. Большая магниевая жесткость придает воде горький привкус, поэтому содержание катионов Mg2+ в питьевой воде не должно превышать 100 мг/л. Общая жесткость питьевой воды во избежание ухудшения ее органолептич. свойств должна быть не более 7 ммоль экв/л; по согласованию с органами санитарно-эпидемиологич. службы иногда допускается увеличение общей Ж. в. до 10 ммоль экв/л. Для устранения или уменьшения Ж. в. применяют спец. методы. Например, из реагентных методов наиб. распространен известково-содовый, который позволяет устранить карбонатную и некарбонатную Ж. в. С помощью ионообменных методов умягчают воду с преобладающей некарбонатной Ж. в. (Na+-катионирование) или карбонатной (H+-катионирование); комбинированием этих методов получают глубоко умягченную воду.
• см. также антинакипины, вода, водоподготовка
Лит.: Руководство по химическому анализу поверхностных вод суши, под ред. А. Д. Семенова. Л., 1977; Унифицированные методы исследования качества вод. ч. 1. Методы химического анализа вод. кн. 1, 2, 3 изд.. М., 1977; Лурье Ю. Ю., Аналитическая химия промышленных сточных вод. М., 1984.
В. А. Гладков
Значения в других словарях
- ЖЕСТКОСТЬ ВОДЫ — ЖЕСТКОСТЬ ВОДЫ, неспособность воды образовывать пену с мылом из-за растворенных в ней солей, в основном кальция и магния. Накипь в котлах и трубах образуется из-за присутствия в воде (1) растворенного карбоната кальция (2)... Научно-технический словарь
- Жесткость воды — Свойство воды, обусловленное присутствием в ней ионов кальция и магния (ГОСТ 27065-86). Экологические термины и определения
- ЖЕСТКОСТЬ ВОДЫ — ЖЕСТКОСТЬ ВОДЫ — совокупность свойств воды, обусловленная наличием в ней преимущественно солей кальция и магния. Использование жесткой воды приводит к осаждению твердого осадка (накипи) на стенках паровых котлов, теплообменников... Большой энциклопедический словарь
