золота галогениды
ЗОЛОТА ГАЛОГЕНИДЫ
моногалогениды AuX, где Х — Cl, Br, I, тригалогениды AuХ3, где X — F, Cl, Br, I, пентафторид AuF3, крайне неустойчивый AuF7, а также галогеноаураты(I, III), содержащие анионы [AuХ2]− или [AuХ4]−, и гексафтороаураты(V). Моногалогениды — кристаллы; при небольшом нагревании разлагаются (2AuX → 2Au + Х2, ЗAuХ : AuХ3 + 2Au). В воде малорастворимы; раств. в конц. водных растворах галогеноводородных кислот и галогенидов металлов с образованием малоустойчивых в присутствии воды комплексов [AuX2]− , которые относительно стабильны в неводных средах (их устойчивость возрастает в ряду Cl < Br < I). С NH3, пиридином, триалкилфосфинами, CO и др. образуют комплексы. Хлорид AuCl (см. табл.) получают разложением в вакууме Н[AuCl4] при 170–205 °C или нагреванием AuCl3 до 175 °C в токе HCl. Бромид AuBr получают нагреванием AuBr3 выше 200 °C. Иодид AuI медленно разлагается влагой воздуха; получают взаимод. раствора Н[AuCl4] с раствором KI, а также из элементов при 393 °C. Тригалогениды AuХ3 раств. в водных растворах НХ и галогенидов металлов, образуя комплексные анионы [AuX4]−; анионы [AuCl4]− и [AuBr4]− устойчивы в водной среде, тетрафторо- и тетраиодоаурат-ионы водой гидролизуются. Галоген в [AuCl4]− и [AuBr4]− легко замещается на др. лиганды. Так, при действии Br2, F2 или KCN на [AlCl4]−образуются соотв. [AuBr4]−, [AuF4]− или [Au(CN4)]−. Тригалогениды образуют комплексы [AuLX3], где L — пиридин, нитрилы; с NH3 дают [Au(NH3)4]3+; AuCl3 и AuBr3 восстанавливаются орг. фосфинами и арсинами, диалкилсульфидами, меркаптанами до соед. Au(I)-[AuLX]. Трифторид AuF3 возгоняется ок. 300 °C, разлагается водой, окислитель, сильный фторирующий агент; легко воспламеняет бензол и др. орг. соединения. Получают взаимод. AuCl3, AuCl или Au с BrF3, XeF2 или F2 при 300–400 °C. Трихлорид AuCl3 димерен; при 180 °C возгоняется; раств. в воде, этаноле и эфире; образует дигидрат AuCl3.2H2O (ΔH0обр −715,6 кДж/моль).
СВОЙСТВА ГАЛОГЕНИДОВ ЗОЛОТА
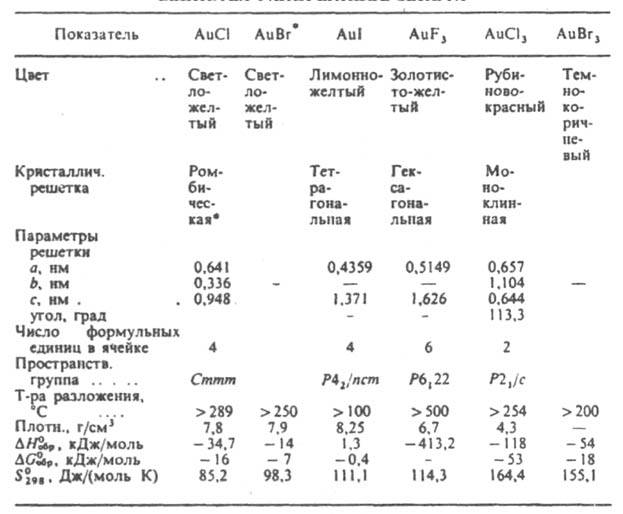
* Имеются сведения о тетрагональной модификации.
При упаривании солянокислого раствора AuCl3 выделяются желтые кристаллы золотохлористоводородной кислоты Н[AuCl4].3H2O (ΔH0обр −1192,9 кДж/моль); известен тетрагидрат Н[AuCl4].4H2O (ΔH0обр −1490,2 кДж/моль). Получают AuCl3: из Au и O2 при 250 °C; реакцией ICl с Au при нагр.; взаимод. Н[AuCl4].3H2O с SOCl2 при 70–80 °C. Трихлорид — промежут. продукт при извлечении Au из руд; его используют для получения коллоидного золота, орг. и неорг. соединений Au, в т. ч. и лекарственных средств, для нанесения покрытий из Au. Золотохлористоводородная кислота — промежут. продукт при получении солей Au, очистке Au при его получении и регенерации из отходов; ее применяют при гальванич. золочении металлических поверхностей, окраске стекла и фарфора. Трибромид AuBr3 разлагается горячей водой. Получают из Au и Br2 при 150 °C. Трииодид AuI3 неустойчив, разлагается на AuI и I2 Пентафторид AuF5 — красно-коричневые или оранжевые кристаллы; выше 80 °C возгоняется;ΔH0обр −473,4 кДж/моль; взрывается в присутствии воды, спирта, эфира; раств. в жидких HF и BrР5; сильный окислитель и фторирующий агент; получают термич. разложением гексафтороауратов(V)Х+[AuF6]−, где Х+ — O2+, NO+, IF6+, XeF5+, Xe2F11+, KrF+, Kr2F3+; и др. (производные Kr и Xe получают взаимод. Au или AuF3 соотв. с KrF2 и ХеF6).
Лит. см. при ст. золото.
Ю. М. Киселев
