номенклатура химическая
НОМЕНКЛАТУРА ХИМИЧЕСКАЯ
совокупность названий индивидуальных хим. веществ, их групп и классов, а также правила составления этих названий.
Номенклатура органических соединений. Первоначально орг. соед. получали тривиальные (несистематические) названия. Они отражали, напр., прир. источник вещества (муравьиная кислота, винная кислота, мочевина, кофеин, молочный сахар), особенно заметные свойства (пикриновая кислота, какодил, гремучая кислота, свинцовый сахар), способы получения (пирогаллол, серный эфир), имя открывшего ученого (кетон Михлера, углеводород Чичибабина). Подобные назв. никак не связаны с хим. природой вещества. В научной номенклатуре (Н.) орг. соед. необходимо указывать как состав вещества, так и отражать в назв. его строение, отличное от строения др. изомеров. Задача составления таких назв. решалась всегда в тесной связи с господствующими теоретич. представлениями.
В нач. 19 в., когда в орг. химии были распространены дуалистич. представления И. Берцелиуса (теория радикалов), появились такие назв., как хлористый бензоил, окись мезитила. С середины столетия в назв. орг. соед. стали отражаться представления теории типов; эти назв. составили первую обширную систему научной Н. орг. соед., т. наз. р а ц и о н а л ь н у ю Н., которая под названием р а д и к а л ь н о-ф у н к ц и о н а л ь н о й Н. входит составной частью в совр. правила.
В 1892 на Международном хим. конгрессе в Женеве была принята Ж е н е в с к а я Н., фундаментом которой явилась бутле-ровская теория хим. строения. Женевская Н. — первый вариант з а м е с т и т е л ь н о й Н., в которой молекулы соед. рассматриваются как продукты замещения атомов Н в молекулах углеводородов на разл. др. атомы или группы-нефункциональные заместители, функц. группы (оба типа заместителей объединяются теперь под названием характе-ристич. групп). Принципы заместительной Н. получили развитие в Льежских правилах (1930), а затем и в современной Н., разрабатываемой международной комиссией по Н. орг. соединений Международного союза теоретич. и прикладной химии (ИЮПАК).
Для составления и расшифровки назв. необходимо пользоваться общепринятыми правилами, однако в то же время Н. не может существовать вне национального языка, в отрыве от его законов. Переплетение международного и национального начал в Н. приводит к тому, что назв. хим. соед. не могут быть формально переведены с одного языка на другой-они должны быть адаптированы и принять соответствующую языковую форму.
Строение молекул орг. соед. выражают при помощи сложных слов-названий, включающих след. фрагменты:
а) обозначение углеродных цепей Сn:С-"мет", C2-"эт", C3-"проп", C4-"бут", C5, ...-корни греч. числительных-"пент", "гекс", "гепт", "окт" и т. д.;
б) обозначения боковых цепей — углеводородных радикалов-состоят из приведенных выше названий углеродных цепей и окончания "ил" (метил, этил, пропил и т. д.);
в) обозначение характера связей между атомами (степени насыщенности): "ан" — насыщенная цепь, "ен"-двойная связь, "ин"-тройная связь;
г) обозначение характеристич. групп, причем одну и ту же группу называют по-разному в зависимости от способа построения назв., а также от того, является ли она старшей (стоит в суффиксе) или младшей (стоит в префиксе);
д) умножающие префиксы — "ди", "три", "тетра" и их модифицир. формы ("5мг", "трис" и т. д.), указывающие число одинаковых структурных элементов;
е) локанты — цифры или буквы, указывающие порядок сочленения составных частей структурной формулы;
ж) разделительные знаки (дефисы, запятые, точки, скобки).
При использовании рациональной Н. назв. орг. соед. строятся на основе простого (не обязательно первого) члена гомологич. ряда с указанием заместителей; в качестве локан-тов используют либо греч. буквы, либо цифры. Примеры:
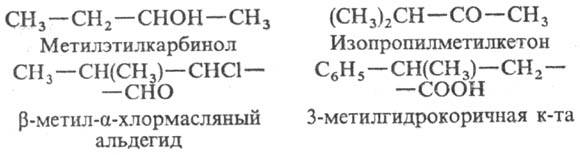
Принципы радикально-функциональной Н. особенно часто используют в назв. сложных карбо- и гетероциклич. соед. (терпены, стероиды, алкалоиды), напр. 2-гидрокси-метиленментан, 2-дезоксирибоза. Чтобы построить формулы по таким назв., надо помнить структуры родовых веществ, положенных в основу названий. Это очевидное неудобство рациональной Н. Другой ее недостаток-сложность, а иногда и просто невозможность построить назв. усложненных структур.
Главное место в современной Н. орг. соед. занимает заместительная Н. При составлении назв. по Н. ИЮПАК (как и при переводе назв. в структурную формулу) последовательно выполняют след. правила: 1) находят осн. характеристич. группу (см. табл.) и выбирают для нее обозначение в суффиксе.
КЛАССЫ СОЕДИНЕНИЙ И НАЗВАНИЯ ХАРАКТЕРИСТИЧЕСКИХ ГРУПП ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ (перечислены в порядке понижающегося старшинства)
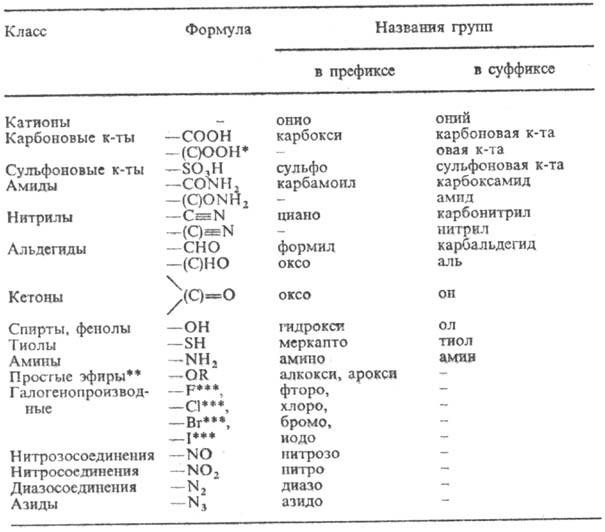
* Здесь и далее атом углерода, заключенный в скобки, включается в назв. исходного соединения (напр., CH3CH2COOH-пропановая кислота). ** Характеристич. группы простых эфиров и всех послед. классов перечисляются в префиксах по алфавиту, старшинства для них нет. *** В отечеств. литературе соединительную гласную "о" опускают (хлор, фтор, бром, иод).
2) Выявляют и называют родовую структуру (осн. цепь, осн. циклич. структуру), к которой примыкает осн. характеристич. группа. В необходимых случаях при этом руководствуются след. старшинством структурных фрагментов (перечисляются в порядке падения старшинства): другие характеристич. группы в порядке падения старшинства, двойная связь, тройная связь, другие префиксные заместители в алфавитном порядке.
3) Определяют степень насыщенности, используя для ее указания суффиксы "ан", "ен", "ик", а в карбо- и гетероциклич. рядах в определенных случаях-также префиксы "дигидро", "тетрагидро" и т. д.
4) Устанавливают характер имеющихся заместителей (боковые цепи, младшие характеристич. группы) и располагают их обозначения в алфавитном порядке в префиксной части названия.
5)Определяют умножающие префиксы, имея в виду, что они не учитываются при алфавитном размещении префиксов.
6) Проводят нумерацию родовой структуры, придавая главной характеристич. группе наименьший из возможных номеров. Локанты ставят перед назв. родовой структуры (напр., 2-бутанол), перед префиксами (напр., 2-хлорпропил-бензол) и после или перед суффиксами (по правилам ИЮПАК перед суффиксом), к которым они относятся (напр., 3-гексен-2-он, 3-гексенон-2).
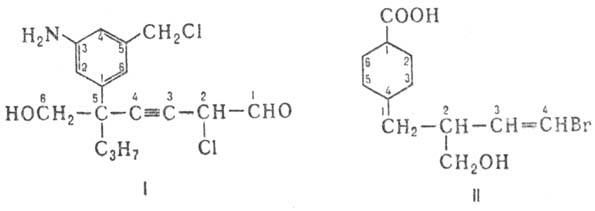
7) Составляют назв. из выше указанных компонент, используя необходимые разделительные знаки. Например, при формировании назв. соед. формулы 1-5-(3-амино-5-хлорметил-фенил)-6-гидрокси-5-пропил-2-хлор-3-гексиналь — выделяются след. составные части: осн. характеристич. группа — альдегид (аль); родовая структура — цепь C6 (гекс); степень насыщенности-тройная связь (ин); заместители-гидроксил (гидрокси), пропил, хлор и замещенный фенил (3-амино-5-хлорметилфенил). Назв. соед. II-4-(4-бром-2-гидроксиметил-3-бутенил)-1 — циклогексанкарбоновая кислота — включает след. фрагменты: карбоновая кислота (осн. группа), циклогексан (родовая структура), бутенил (боковая цепь C4 с двойной связью), бром, гидроксиметил (заместители в боковой цепи C4).
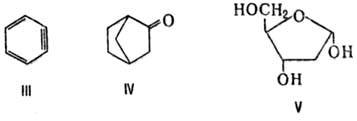
Наряду с заместительными назв. правила ИЮПАК допускают возможность применения и др. типов Н. Так, пра использовании а д д и т и в н о й (присоединительной) Н. к назв. осн. части молекулы добавляют назв. присоединенных к ней атомов, напр. 1,2,3,4-тетрагидрохинолин, пропиленоксид. С у б с т р а к т и в н а я Н. указывает на удаление определенных атомов или групп, напр. дегидробензол (формула III), норкамфора (IV), 2-дезоксирибоза (V). Кроме того, используют заменительную Н. (т. наз. a-номенклатура; см. гетероциклические соединения), напр.:
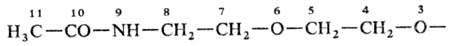
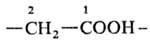 10-оксо-3,6-диокса-9-азаундекановая кислота, соед. V1-2,3-Дитиа-1,5-диазаиндан; Н. к о н д е н с и р о в а н н ы х систем, в которой с помощью соединит. буквы "о" указывают слияние двух циклов в систему с неск. общими атомами, напр. бензофуран; н о м е н к л а т у р а Г а н ч а-В и д м а н а для гетероциклич. систем, в которой назв. образуется из префиксов, указывающих природу гетероатома, и суффикса, зависящего от числа звеньев в кольце, напр. 1,3-тиазол (формула VII),
10-оксо-3,6-диокса-9-азаундекановая кислота, соед. V1-2,3-Дитиа-1,5-диазаиндан; Н. к о н д е н с и р о в а н н ы х систем, в которой с помощью соединит. буквы "о" указывают слияние двух циклов в систему с неск. общими атомами, напр. бензофуран; н о м е н к л а т у р а Г а н ч а-В и д м а н а для гетероциклич. систем, в которой назв. образуется из префиксов, указывающих природу гетероатома, и суффикса, зависящего от числа звеньев в кольце, напр. 1,3-тиазол (формула VII),
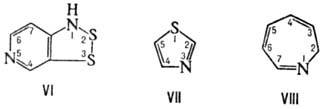
2H-азепин (VIII); к о н ъ ю н к т и в н у ю (объединительную), если циклич. система связана через атом С или N с атомом С алифатич. цепи, несущей главную группу, напр. 2-нафталинуксусная кислота.
В. М. Потапов
Номенклатура неорганических соединений. В основе назв. неорг. веществ лежат рус. назв. хим. элементов (см. периодическая система химических элементов, элементы химические), которые в большинстве случаев совпадают с латинскими. Исключениями являются корни иноязычных назв. "анти-мон" (сурьма), "аргент" (серебро), "аре" или "арсин" (мышьяк), "аур" (золото), "гидр" (водород), "карб" или "карбон" (углерод), "купр" (медь), "манган" (марганец), "меркур" (ртуть), "нитр" (азот), "оке" или "оксиген" (кислород), "плюмб" (свинец), "сил", "силиц" или "силик" (кремний), "станн" (олово), "стиб" (сурьма), "сульф" или "тио" (сера) и "ферр" (железо). Примеры: антимонид, карбид, карбонат, силан, силицид, силикат, стибин; исключения: назв. "азид" и "озонид". Для соединения Хе, Mo и Р используют усеченные корни рус. назв. (перксенат, молибдат, фосфид). Производные изотопов водорода называют, используя корни "дейтер" или "дейтерио" и "трит" или "три-тио".
В формулах хим. соед. обычно первым указывают электро-положит. элемент или катион, а затем электроотрицательный или анион, напр. NaCl, Al2(SO4)3. Стехиометрич. соотношения в формулах, как правило, выражают целыми числами, а сами формулы дают без учета степени ассоциации соединений.
Название соед. дают двумя словами: электроотрицат. элемент или анион и электроположит. элемент или катион. Назв. электроотрицат. части соед. образуют с помощью суффиксов "ид" или "ат", назв. электроположит. части дают в родительном падеже. В случае необходимости используют числовые префиксы "геми", "моно" (обычно опускают), "сескви", "ди", "три", "тетра" и т. д., а когда возможно неоднозначное понимание — умножающие числовые префиксы "бис", "трис", "тетракис" или в скобках после назв. элемента (чаще всего металла) указывают римскими цифрами степень его окисления. Примеры: NaCl-хлорид натрия, K2[ZrF6]-гексафтороцирконат калия, SiCl4-тетрахлорид кремния, CrO3-триоксид хрома, оксид xpoMa(VI), P2O5-оксид фосфора(V).
Традиц. назв. некоторых бинарных соед. и комплексных соед., не содержащих внеш. сферы, дают в одно слово, напр.: NH3- аммиак, SiH4-силан, Ni(CO)4-тетракарбонилникель.
П р о с т ы е веществ а наз., как правило, аналогично хим. элементам. Чтобы различить число атомов в молекуле, используют прилагательные "атомный", "молекулярный" и тра-диц. назв., напр.: Н-атомный водород, O2-молекулярный кислород, Sn- аморфная сера, Р4- белый фосфор, O3-озон.
Заряд ионов показывают надстрочным индексом в формуле, назв. анионов образуют, добавляя суффикс "ид", напр.: Na+ — натрий, катион натрия, Fe2+ — катион железа(II), желе-зо(II), H−-гидрид-ион, F−-фторид-ион, О2−-оксид-ион, S2−-сульфид-ион. Некоторые распространенные ионы имеют традиц. назв.: О+2 — диоксигенил, катион диоксигенила, C22− — ацетиленид-ион, N−3 — азид-ион, О−3 — озонид-ион, О−2 — надпероксид-ион, O22− — пероксид-ион.
Предложено также называть простые вещества и ионы, указывая число атомов и заряд ионов, напр.: O2-дикислород, O3 — трикислород, S8 — октасера, Рn — полифосфор, Hg22+ — катион диртути(2 + ), I−3-трииодид (1-)-ион.
При составлении хим. формул бинарных соед. учитывают, что электроотрицательность неметаллов увеличивается в ряду Rn, Хе, Kr, В, Si, С, As, Р, Н, Те, Se, S, At, I, Br, Cl, N, O, F, напр.: В4С-карбид бора, Cl2O-гемиоксид хлора, оксид хлора(I), NO-оксид азота, ОF2-дифторид кислорода, SiCl4-тетрахлорид кремния. Исключение из общих правил среди галогенидов составляют HF, HCl, HBr и HI, сохранившие традиц. назв. — фтористый, хлористый, бромистый и йодистый водород. Растворы этих веществ в воде называют фтористо-, хлористо- (соляной), бромисто- и иодистоводород-ной кислотами, азеотропную смесь HF-H2O-плавиковой кислотой.
Среди оксидов исключениями являются H2O-вода, соед. с ионами O22−-пероксиды и О−3-озониды. Мн. гидриды называют, прибавляя суффиксы "ан" или "ин": BH3-боран, SiH4-силан, SnH4-станнан, PH3-фосфин, AsH3-арсин, SbH3-стибин. Для обозначения числа атомов Н используют числовые префиксы или скобки: В2H6-диборан, диборан(6), Si3H8-трисилан(8), В5H9-пентаборан(9), В5H11-пентабо-ран(11). Исключениями среди нитридов являются NH3-аммиак, N2H4-гидразин, HN3-азидоводород, среди сульфидов-H2S-сероводород, H2S2-дисульфан, H2S3-трисульфан и т. п. Это же относится к H2Se-селеноводород, H2Те-теллуроводород и растворам H2S, H2Se, H2Те в воде-сероводородная, селеноводородная и теллуроводородная кислоты. Назв. интерметаллидов, кроме простейших, повторяют их формулы, напр.: SmCo5-самарий-кобальт-пять.
Многие бинарные соед. в действительности являются комплексными, что обусловливает двойственность их названия: NiF3 или Ni[NiF6]-трифторид никеля, гексафторо-никелат(IV) никеля(II).
П с е в д о б и н а р н ы е с о е д. включают псевдогалогениды (ионы которых образованы устойчивыми атомными группами, напоминающими по свойствам галогены), гидроксиды и др., напр.: Fe(СN)2-дицианид железа, цианид железа(II), NaOH-гидроксид натрия. Назв. соед. с ионами NH+2 (амид) и NH+ (имид) образуются особо: NH2Cl-хлорамин, NHI2-иодимид.
К и с л о р о д с о д е р ж а щ и е кислот ы называют по традиционной рус. Н. путем присоединения к корню рус. назв. хим. элемента окончания "ная", "овая", "евая" (высшая или единств. степень окисления элемента), "новатая" (промежут. степень), "(ов)истая" и "новатистая" (низшая степень), напр.: H2SO4-серная, НMnO4-марганцовая, H2GeO3-германиевая, HClO, — хлорноватая, HClO2 — хлористая, HNO2-азотистая, HClO-хлорноватистая кислота. Традиционные названия сохраняются и для др. кислот, напр.: H2CO3-угольная, НAuCl6 — золотохлористоводородная, НВF4 — борофтористоводородная, H2SiF6 — кремнефтористоводо-родная, HSO3Cl-хлорсульфоновая. Кислоты, образованные переходными металлами, наз. с указанием степени их окисления: НRеО4-рениевая(VII), H2RеО4-рениевая(VI), НRеO3-рениевая(V). Кислоты с элементом водной и той же степени окисления, но содержащие разл. формальное количество воды, различают префиксами "орто" (большое количество) или "мета" (малое количество), напр.: H3AsO3-ортомышьяковистая, HAsO2 — метамышьяковистая кислота.
С р е д н и е с о л и называют, сочетая назв. аниона и катиона. Если элемент, образующий анион, имеет разл. степени окисления, то для высшей и низшей из двух при использовании традиционных назв. применяют суффиксы "ат" и "ит" (На2SeО4-селенат, Na2SeO3-селенит), при наличии трех степеней окисления для низшей используют префикс "гипо" и суффикс "ит" (NaNO2-нитрит, Na2N2O2-гипонитрит натрия); при четырех разл. степенях окисления для высшей применяют префикс "пер" и суффикс "ат" (KClO4-перхлорат, KClO3-хлорат калия). Во всех остальных случаях для назв. аниона используют суффикс "ат" и указывают степень окисления анионообразующего элемента римскими цифрами в скобках [арсенат(III), арсенат(V), феррат(II), феррат(III)]. В назв. солей могут сохраняться префиксы "орто", "мета" и др.
К и с л ы е и о с н о в н ы е с о л и содержат в назв. префикс соотв. "гидро" или "гидроксо": KHSO4- гидросульфат калия, КаH2PO4-дигидрофосфат натрия, KH2F3-дигидро-трифторид калия, К[Au(OH)4]-тетрагидроксоаурат(III) калия, Fe(ОН)NO3-гидроксонитрат железа(II), Cu2(OH)2CO3-дигидроксокарбонат меди(II).
О к с о-, п е р о к с о- и т и о с о л и содержат соответствующие префиксы: TiO(NO3)2-оксонитрат титана, ZrOCl2-оксохлорид циркония, K4P2O5 — пероксодифосфат калия, Na2S2O3-тиосульфат натрия.
Мн. и о н ы и р а д и к а л ы имеют специфич. названия: СО-карбонил, NO-нитрозил, NO2- нитрил, РО-фосфо-рил, SO-тионил (сульфинил), SO2-сульфурил (сульфонил), S2O5-дисульфурил, VO2+ — ванадил, UO22+-уранил (аналогично для трансурановых элементов), ClO-хлорозил, ClO2-хлорил, ClO3-перхлорил (аналогично для брома и иода). Обычно они включаются в назв., состоящее из одного слова, напр.: СОF2-карбонилфторид, UO2SO4-уранил-сульфат.
М н о г о а т о м н ы е п р о с т ы е с о е д., к которым относят смешанные галогениды, оксо- и тиогалогениды, а также аналогичные соед., записывают и называют в порядке возрастания электроотрицательности, напр.: NbCl2F3-дихлоротрифторид ниобия, WOCl4-оксотетрахлорид вольфрама, WSF4-тиотетрафторид вольфрама. Реже используют назв. типа "дихлорид-трифторид ниобия", "оксид-тетрахлорид вольфрама". Соед., содержащие кристаллизац. воду, называют г и д р а т а м и, напр.: Na2CO3∙10H2O-декагидрат карбоната натрия.
П о л и м о р ф н ы е м о д и ф и к а ц и и обозначают греч. буквами, реже латинскими буквами или римскими цифрами. При этом, как правило, букву а относят к высокотемпературной модификации, напр.: a-Fe (a-модификация железа, a-желе-зо), b-WO3 (b-триоксид вольфрама), Sr (r-сера). Для обозначения аморфного состояния используют латинскую букву a: a-Si (аморфный кремний). О Н. комплексных соед. см. координационные соединения.
Лит.: Номенклатурные правила ИЮПАК по химии, пер. с англ., т. 1–4, М., 1979–85; Кан Р., Дермер О., Введение в химическую номенклатуру, пер. с англ., М., 1983; Основы номенклатуры неорганических веществ, М., 1983; "Ж. Всес. хим. общества им. Д. И. Менделеева", 1983, т. 28, № 3 (спец №); Бокий Г. Б., Голубкова Н.А., Введение в номенклатуру ИЮПАК, М., 1989.
Э. Г. Раков
Значения в других словарях
- Номенклатура химическая — Система рациональных названий химически индивидуальных веществ. Первая такая система была выработана в 1787 Комиссией французских химиков под председательством А. Л. Лавуазье. Большая советская энциклопедия
- Номенклатура химическая — См. Химическая номенклатура. Энциклопедический словарь Брокгауза и Ефрона
