дипиридилы
ДИПИРИДИЛЫ (бипиридины, бипиридилы, пиридилпиридины)
мол. м. 156,18; бесцветные кристаллы (за исключением 2,3'-Д., см. табл.). 2,2'-Д. — плоская молекула; параметры решетки: а = 0,565 нм, b = 0,622 нм, с =1,354 нм; β=119°20'; z = 2. 4,4'-Д. — неплоская молекула с углом поворота плоскостей 37,2°; аналогичную конформацию имеют 3,3'- и 3,4'-Д.
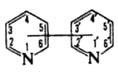
2,2'-, 2,3'- и 2,4'-Д. хорошо раств. в органических растворителях, плохо — в воде. 3,3'-Д. хорошо раств. в воде и этаноле, плохо — в диэтиловом эфире. 3,4'-Д. гигроскопичен и расплывается на воздухе; до 12,8 °C хорошо раств. в воде, выше этой температуры теряет растворимость.

Д. — слабые основания, рKа 4,44–4,82. С солями металлов, S2Cl2, SO3, орг. галогенидами, фенолами и аминами Д. образуют окрашенные комплексы. При восстановлении 4,4'- или 2,2'-Д. под действием CrCl2 в кислой среде или Zn в нейтральной или слабокислой среде образуются окрашенные продукты — виологены, имеющие строение, сходное с хингидроном. Действие Na в спирте, Al в щелочной среде или H2 над оксидом Pt либо скелетным Ni приводит к смеси продуктов восстановления одного или обоих гетероциклич. колец. Д. устойчивы к действию окислителей, однако с H2O2 в присутствии CH3COOH дают моно-или ди-N-оксиды, с KMnO4 в H2SO4 — пиколиновую, никотиновую или изоникотиновую кислоту или их смеси. Аминирование NaNH2 идет в положения 2,2' и 6,6'; сульфирование и бромирование — в положения 3,3' и 5,5' с образованием моно-, ди- или тетрапроизводных. Реакция 2,2'-Д. с I2 или FeCl3 приводит к 2,2', 2:, 2:'-тетрапиридину. Нитрование Д. осуществить не удается. С алкилгалогенидами и диметилсульфатом Д. реагируют при нагр. в запаянных ампулах с образованием моно- или дичетвертичных солей. Смесь 4,4'- и 2,2'-Д. получают взаимод. пиридина со щелочными или щел.-зем. металлами и послед. окислением образующегося дигидро-Д. хлором или HNO3, индивидуальный 4,4'-Д. — взаимод. пиридина с Zn-пылью в уксусном ангидриде в присутствии металлсодержащих катализаторов (Ni, Pd, Fe). Общие методы синтеза других Д.: взаимод. соответствующих галогенпиридинов с Cu (реакция Ульмана); диеновый синтез оксазолов с 2- или 4-винилпиридинами. Д. — структурные фрагменты ряда алкалоидов, напр., анабазина, анатобина, оренсина, гистрина. Комплексы 2,2'-Д. и 4,4'-Д. с металлами используют в аналит. химии для фотометрич. определения ионов Fe2+, Ag+, Cu2+, Zn2+, Ru2+ и др.; ярко-красный комплекс 2,2'-Д. с Fe2+ — окислительно-восстановит. индикатор (потенциал перехода окраски + 1,33 В), краситель для шелка и шерсти. Производные 2,2'- и 4,4'-Д., напр., дикват и паракват, — гербициды сплошного действия. 2,2'-Д. подавляет окислит. процессы в организме, 3,3'-Д. изменяет кровяное давление.
Лит.: Пилипенко А. Т., Фалендыш Е. Р., "Успехи химии", 1972, т. 41, в. 11, с. 2094–2127; Мельников Н. Н., Новиков Е. Г., Хаскин Б. А., Химия и биологическая активность дипиридилов и их производных, М., 1975.
П. Б. Терентьев
