ниобия галогениды
НИОБИЯ ГАЛОГЕНИДЫ
Известны пентагалогениды NbX5, тетрагалогениды NbX4 (большинство содержат группы Nb2), тригалогениды — фазы состава NbX2,67 (или Nb3X8)-NbX3+x (содержат группы Nb3 и Nb2), галогениды Nb6Xn, Nb6X14 и Nb6X15 с октаэдрич. группировками Nb6, оксигалогениды NbOX3, NbO2X и др., галогенсодер-жащие кислоты Nb, фторо-, оксофторо-, пероксофторо-, хлоро-, оксохлорониобаты, а также смешанные Н.г., напр. NbCl4F, тио- и селеногалогениды, напр. NbS2X2, NbSe2X2. Свойства важнейших Н.г. приведены в таблице.
СВОЙСТВА ГАЛОГЕНИДОВ НИОБИЯ И НЕКОТОРЫХ ИХ ПРОИЗВОДНЫХ
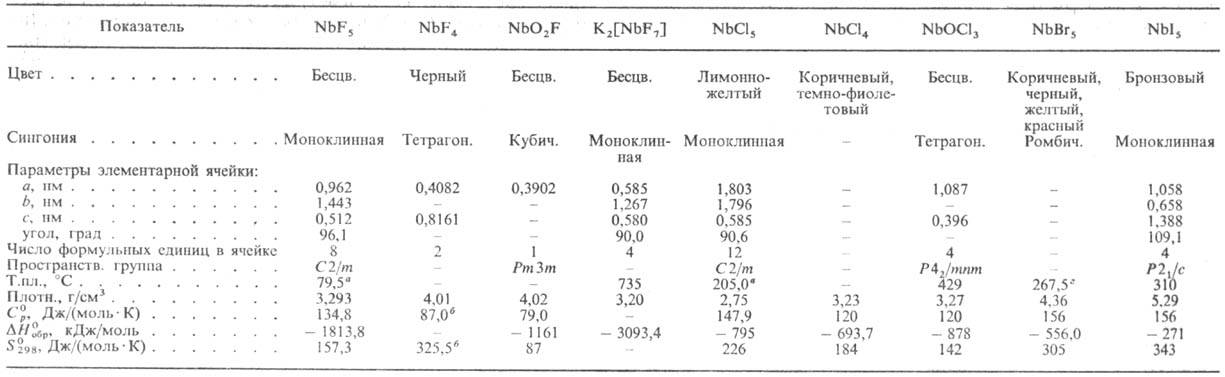
а Т.кип. 234,5 °C. б Для газа. в Т.кип. 247,5 °C. г Т.кип. 362,0 °C.
П е н т а ф т о р и д н и о б и я NbF5 в парах ниже 400 °C полимеризован; ΔH0пл 12,2 кДж/моль, ΔH0исп 51 кДж/моль; уравнение температурной зависимости давления пара lgр(IIa) = = 10,497-2778/Т (373 ≤ Т<= 423 К). Гидролизуется водой; восстанавливается Si, Nb и др. металлами до низших фторидов, выше 900 °C водородом—до металла. NbF5 — кислота Льюиса. Образует фторониобаты M[Nb3F16], M[Nb2F11], M[NbF6] и др. Получают взаимод. Nb либо Nb2O5 с F2 при 300–450 °C или Nb с газообразным HF при 250–400 °C. NbF5-промежут. продукт при получении Nb и Nb2O5; перспективен как реагент для получения покрытий из Nb и катализаторов гидрирования нефтепродуктов. Т е т р а ф т о-р и д н и о б и я NbF4 при 350–500 °C диспропорционирует до Nb6F15 и NbF5; гидролизуется водой. Фторид Nb6F15-темно-коричневые кристаллы с кубич. решеткой; выше 700 °C диспропорционирует до Nb и NbF5. Д и о к с и ф т о р и д NbO2F выше 550 °C диспропорционирует до Nb3O7F (далее до Nb2O5) и газообразного о к с о т р и ф т о р и д а NbOF3; получают выпариванием досуха раствора Nb во фтористоводородной кислоте, взаимод. Nb2O5 с F2, HF, NbF5. При растворении Nb2O5 во фтористоводородной кислоте образуются ф т о р о к и с л о т ы н и о б и я Nb2F11 ∙4H2O, HNbF6∙6H2O и HNbF6∙H2O.
Г е п т а ф т о р о н и о б а т к а л и я K2[NbF7] плохо раств. во фтористоводородной кислоте (~ 3,5% по массе в пересчете на NbF5 в 25%-ной HF); получают действием KCl на раствор Nb во фтористоводородной кислоте; применяют для электролитич. или металлотермич. получения Nb. Г е к с а ф т о р о о к с о н и о-б а т а м м о н и я (NH4)3[NbOF6] — бесцветные кристаллы с кубич. решеткой; плотн. 2,28 г/см3; при 255, 320 и 420 °C ступенчато разлагается до NbOF3, NbO2F и паров NbF5; получают взаимод. Nb2O5 с NH4HF2, как примесь при осаждении гидроксида Nb действием води. NH3 на фторидные растворы Nb.
Для п е н т а х л о р и д а н и о б и я NbCl5 температура полиморфного перехода 183 °C, DH перехода 6,4 кДж/моль, ΔH0пл 34 кДж/моль, ΔH0исп 52 кДж/моль; уравнения температурной зависимости давления пара: lgр(Па) = 24,3834–5353/Т- 3,2204 lgT-7649/T2 (350 ≤T≤ 383 К), lgp(Па) = 10,49-2870/Т (483 ≤ Т≤ 572 К); гидролизуется водой; раств. в CCl4, бензоле, толуоле и др. органических растворителях; образует аддукты с орг. основаниями, с хлоридами металлов-х л о р о — н и о б а т ы M[NbCl6]. Получают взаимод. Nb с Cl2 или CCl4 при 300–500 °C, Nb2O5 с CCl4, смесей Nb2O5 (или концентратов Nb с С) с Cl2. NbCl5-промежут. продукт при получении чистого Nb2O5, покрытий и монокристаллов из Nb хим. осаждением из газовой фазы (NbCl5 + 2,5 H2 → 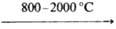 Nb + 5HCl) или поликристаллич. Nb электролизом в среде NaCl-KCl. Тетрахлорид ниобия NbCl4 выше 300 °C диспропорционирует до NbCl3 и NbCl5, возгоняется в парах NbCl5; раств. в воде, давая синие растворы; образует аддукты с орг. основаниями; получают взаимод. NbCl5 с H2, Nb или др. металлами при 450–500 °C. Три-хлорид состава NbCl2,67-NbCl3,13 выделяют при взаимодействии NbCl5 с H2 при 500–550 °C; не раств. в воде и разб. кислотах, окисляется конц. HNO3. Низшие хлориды — зеленый Nb3Cl8 и черный Nb6Cl14 получают при термич. разложении NbCl4. О к с о т р и х л о р и д NbOCl3 получают взаимод. NbCl5 с O2 при 150–300 °C, NbCl5 с Nb2O5 при 200–350 °C, как побочный продукт при получении NbCl5.
Nb + 5HCl) или поликристаллич. Nb электролизом в среде NaCl-KCl. Тетрахлорид ниобия NbCl4 выше 300 °C диспропорционирует до NbCl3 и NbCl5, возгоняется в парах NbCl5; раств. в воде, давая синие растворы; образует аддукты с орг. основаниями; получают взаимод. NbCl5 с H2, Nb или др. металлами при 450–500 °C. Три-хлорид состава NbCl2,67-NbCl3,13 выделяют при взаимодействии NbCl5 с H2 при 500–550 °C; не раств. в воде и разб. кислотах, окисляется конц. HNO3. Низшие хлориды — зеленый Nb3Cl8 и черный Nb6Cl14 получают при термич. разложении NbCl4. О к с о т р и х л о р и д NbOCl3 получают взаимод. NbCl5 с O2 при 150–300 °C, NbCl5 с Nb2O5 при 200–350 °C, как побочный продукт при получении NbCl5.
П е н т а б р о м и д NbBr5 получают из Nb и Br2 при 500 °C, т е т р а б р о м и д NbBr4 (коричневое твердое вещество) — реакцией NbBr5 с Nb при 200–400 °C П е н т а и о д и д NbI5 (разлагается при нагр., гидролизуется водой) синтезируют из Nb и I2 при 250–600 °C, т е т р а и о д и д NbI4, т р и и о д и д NbI3 и низшие иодиды — при термич. разложении NbI5.
Э. Г. Раков, В. А. Мусорн
