сульфокислоты
СУЛЬФОКИСЛОТЫ (сульфоновые кислоты)
соед. общей формулы RSO3H, где R — Alk, Ar, гетероциклич. радикал. Классифицируют С. в зависимости от природы R, наличия заместителей и количества групп SO3H.
С. называют, добавляя к названиям соединения-основы окончание "сульфокислота" (сульфоновая кислота), напр. 4-пиперидинсульфокислота. Если в соединении присутствует другая группа, имеющая приоритет, к названиям соединения-основы добавляют префикс "сульфо", напр. n-сульфобензойная кислота. Некоторые С. имеют тривиальные названия.
Сульфогруппа имеет тетраэдрич. строение. В сульфонат-анионе 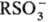 для всех связей S—О длина 0,139 нм, угол OSO ~ 109°; для ароматич. соединений константы Гаммета σмета 0,38, σпара 0,58.
для всех связей S—О длина 0,139 нм, угол OSO ~ 109°; для ароматич. соединений константы Гаммета σмета 0,38, σпара 0,58.
В ИК спектрах С. присутствуют характеристические полосы в области 1340–1350 и 1150–1160 см−1, соответствующие асимметрическим и симметрическим валентным колебаниям группы SO2. В УФ области С. не поглощают. В спектре ПМР хим. сдвиг (d) протона сульфогруппы 11–12 м. д.
С. мало распространены в природе. Из алифатических С. выделены таурин NH2CH2CH2SO2OH и цистеиновая кислота NH2CH(CH2SO2OH)COOH-метаболиты обмена веществ животных; из ароматических-6-амино-1 — карбокси-10-метил-3-сульфофеназин (аэругинозин В).
Низшие алкансульфокислоты- низкоплавкие кристаллич., сильно гигроскопичные вещества, по кислотности близки к H2SO4. Наиб. сильная-трифторметансульфокислота (сравнима с фторсульфоновой кислотой).
С. обладают всеми характерными свойствами кислот: образуют соли и эфиры (сульфонаты), галогенангидриды (сульфогалогениды), ангидриды, амиды и т. д. При восстановлении С. или сульфохлоридов цинковой пылью образуются сульфиновые кислоты RS(O)OH, при использовании сильных восстановителей или в кислой среде-тио-лы RSH.
С. присоединяются по кратным связям алкенов, алкинов, алленов и др., напр.:
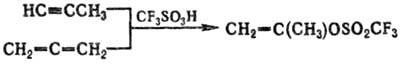
Для ароматических С. характерны реакции обмена сульфогруппы на др. функц. группы, напр.:
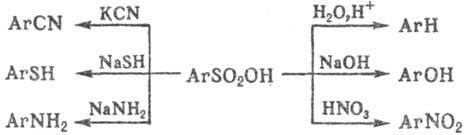
Получают С. 4 осн. методами.
1) Сульфирование органических соединений. В качестве сульфирующих агентов применяют H2SO4, олеум, SO3 или его комплексы с пиридином, диоксаном и др., а также ClSO2OH. Наиболее легко сульфируются активированные гетероароматические соединения. Важнейшее практическое значение имеет сульфирование ароматических углеводородов.
При действии сульфирующих агентов на алифатич. альдегиды, кетоны, карбоновые кислоты и их производные сульфогруппа направляется в α-положение, при действии на олефины образуются алкенсульфокислоты и сультоны, при действии на ацетилен-алкинсульфокислоты наряду с др. продуктами, напр.:
RCH2COX + SO3 → RCH(SO2OH)COX X = H, OH, R', OR', NR'2 и др.
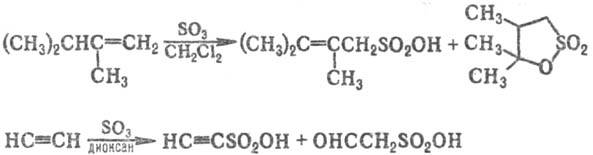
2) Окисление тиолов, сульфидов, ксантогенатов, тиоцианатов и т. д. В качестве окислителей используют HNO3, H2O2, оксиды азота, пероксикислоты, KMnO4,O3,O2, напр.:
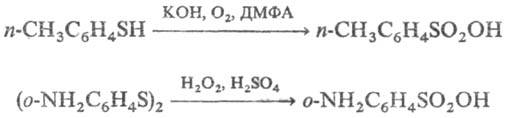
3) Сульфоокисление и сульфохлорирование, как правило, алифатич. углеводородов:
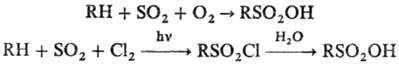
Реакции идут по свободнорадикальному механизму. Из высокомол. алканов образуются смеси продуктов; эти процессы используют гл. обр. в промышленности.
4) Нуклеоф. замещение и присоединение к кратным связям с участием сульфит-иона. Нуклеоф. атаке могут подвергаться алкил- и арилгалогениды, оксираны, активир. алкены, ароматич. соед., карбонилсодержащие соед., напр.:
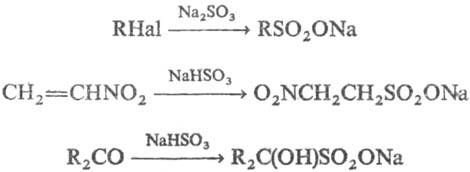
Неактивир. алкены и алкины реагируют с сульфит-ионом в условиях свободнорадикального присоединения.
Качеств. определение С. основано на взаимод. с NH2OH с образованием сульфогидроксамовой кислоты RSO(OH)NOH и далее с CH3CHO; при добавлении РеCl3 раствор окрашивается в темно-красный цвет, переходящий в фиолетовый цвет. Для количеств. определения используют физ.-хим. методы, а также титрование растворами щелочей и осаждение в виде солей тяжелых металлов.
Ароматические С. — полупродукты в производстве фенолов, нафтолов, красителей, лекарственных средств (гл. обр. сульфамидных препаратов), ионообменных смол, дезинфицирующих средств (моно- и дихлорсульфамидов). Техн. смесь метан-, этан- и пропансульфокислот используют в качестве растворителя, а также катализатора этерификации, ацилирования, нитрования, нитрозирования и др. процессов. Соли алкансульфокислот-моющие средства, ПАВ, эмульгаторы, флотореагенты, присадки к техн. маслам, ингибиторы коррозии и т. п.
• см. также метансульфокислота, бензолсульфокислоты, нафталинсульфокислоты, нафтолсульфокислоты, толуолсульфокислоты
Лит.: Джильберт Э. Е., Сульфирование органических соединений, пер. с англ., М., 1969; Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 508–18.
А. Ф. Елеев
Значения в других словарях
- Сульфокислоты — Сульфоновые кислоты, RSO3H (R — углеводородный радикал алифатического или ароматического ряда), обычно кристаллические гигроскопичные вещества, хорошо растворимые в воде. По кислотности С. близки к минеральным кислотам. Ароматические... Большая советская энциклопедия
- сульфокислоты — орф. сульфокислоты, -от, ед. -ота, -ы Орфографический словарь Лопатина
- СУЛЬФОКИСЛОТЫ — СУЛЬФОКИСЛОТЫ (сульфоновые кислоты) — органические соединения, содержащие сульфогруппу — SO2ОН, связанную с органическим радикалом R. Получают сульфированием углеводородов, гидролизом сульфохлоридов RSO2Cl и др. Большой энциклопедический словарь
- Сульфокислоты — См. Сульфоновые к. Энциклопедический словарь Брокгауза и Ефрона
