хлор
ХЛОР (от греч. chloros — желто-зеленый; лат. Chlorum) Cl
хим. элемент VII гр. периодической системы, относится к галогенам; ат. н. 17, ат. м. 35,453. Прир. Х. состоит из смеси двух изотопов 35С1 (75,77%) и 37С1 (24,23%); ядра обоих изотопов имеют электрич. квадрупольный момент. Конфигурация внеш. электронной оболочки атома 3s23р5; степени окисления −1 (хлориды), +1 (гипохлориты), +3 (хлориты), +5 (хлораты) и +7 (перхлораты); сродство к электрону 3,614 эВ; потенциал ионизации при последоват. переходе от С1° к С17+ 12,96776, 23,805, 39,90, 53,50, 67,80, 96,7 и 114,27 эВ; электроотрицательность по Полингу 3,16; ковалентный радиус С1° 0,099 нм; ионные радиусы (в скобках указаны координац. числа) Cl−0,167 нм (6), С15+ 0,026 нм (3), С17+ 0,022 нм (4), 0,041 нм (6).
Молекула Х. двухатомна, длина связи (в газе) r = 0,1987 нм. Имеет два связанных состояния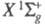 и
и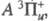 последнее — возбужденное с энергией 2,2109 эВ и r = 0,2435 нм. Эти состояния коррелируют с валентными состояниями атома хлора
последнее — возбужденное с энергией 2,2109 эВ и r = 0,2435 нм. Эти состояния коррелируют с валентными состояниями атома хлора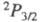 и
и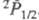 . Сродство Cl2 к электрону 2,45 эВ, потенциал ионизации 11,48 эВ. Энергия диссоциации Cl2 239,240 кДж/ моль, равновесная термич. диссоциация Cl2 на атомы определяются константой К°(Т) =р2(Cl)/р(Cl2), где р — давление; lgК° = −6,8257 (1000 К), 0,2660 (2000 К), 1,9617 (3000 К).
. Сродство Cl2 к электрону 2,45 эВ, потенциал ионизации 11,48 эВ. Энергия диссоциации Cl2 239,240 кДж/ моль, равновесная термич. диссоциация Cl2 на атомы определяются константой К°(Т) =р2(Cl)/р(Cl2), где р — давление; lgК° = −6,8257 (1000 К), 0,2660 (2000 К), 1,9617 (3000 К).
Среднее содержание Х. в земной коре 1,7∙10−2% по массе. Очень велики запасы Х. в мировом океане (среднее содержание 18,83 г/л); в виде NaCl (50–240 г/л) находится в подземных рассолах. В земной коре Х. встречается в осн. в виде каменной соли (галита) NaCl, карналлита KCl x MgCl2 x 6H2O, сильвина KCl, сильвинита NaCl x KCl, каинита KCl MgSO4 x3H2O, бишофита MgCl2 x 6H2O, тахгидрита 2MgCl2 x CaCl2 x 12H2O; другие менее распространенные минералы — кераргирит AgCl, бисмоцелит BiOCl, псевдокотуннит K2PbCl4, баумлерит 2KCl xCaCl2. Содержание Х. в силикатных (каменных) метеоритах 0,09%, в железных — 0,36% (в осн. в виде FeCl3), в вулканич. газах — до 1,3% (в виде Cl2, HCl, NaCl и др.). Содержание Х. в человеческом теле 0,25% (0,45% от сухой массы); в плазме крови 0,32–0,37%, в растениях зависит от вида и от состава почвы, напр., табак содержит 2,3% X., морковь — 1,5%, зерно — 0,05%, картофель — 0,03%.
Свойства. Х. — желто-зеленый газ с резким удушающим запахом; т. пл. −100,98 °C, т. кип. −33,97 °C; тройная точка: температура 172,17 К, давление 1,392 кПа, dp/dT= 0,128 кПа/К; tкрит143,75 °C, pкрит7977,3 кПа, dкрит 0,573 г/см3; уравнение температурной зависимости плотн. в интервале от −90 до 80 °C d= 1,6583346 — 0,002003753/(t + 80) + 0,0545596743 x (t+ 80)2 г/см3, при 25 °C плотн. 3,214 г/см3, плотн. твердого при −195 °C 2,13 г/см3; для Cl2: 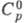 33,949 Дж/(моль∙К),
33,949 Дж/(моль∙К), 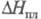 6,757 кДж/моль,
6,757 кДж/моль, 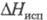 22,43 кДж/моль,
22,43 кДж/моль, 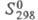 222,965 Дж/ (моль∙К); для атома С1 (газ):
222,965 Дж/ (моль∙К); для атома С1 (газ): 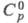 21,838 Дж/(моль∙К),
21,838 Дж/(моль∙К), 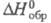 121,302 кДж/моль,
121,302 кДж/моль, 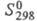 165,076 Дж/(моль∙К); для иона Cl−(газ):
165,076 Дж/(моль∙К); для иона Cl−(газ): 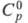 20,786 Дж/(моль∙К),
20,786 Дж/(моль∙К), 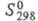 153,346 Дж/(моль∙К),
153,346 Дж/(моль∙К), 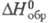 −233,670 кДж/моль,
−233,670 кДж/моль, 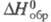 Cl− (в воде) −167,080 кДж/ моль; уравнение температурной зависимости давления пара lnp = A + B/T+ClnT+DT+E(F-T)/FT (205–417 К), где А = 62,402508, В = -4343,5240, С = -7,8661534, D = = 1,0666308∙10−2, E = 95,248723, F = 424,90; при 20 °C давление пара Cl2 0,669 МПа;
Cl− (в воде) −167,080 кДж/ моль; уравнение температурной зависимости давления пара lnp = A + B/T+ClnT+DT+E(F-T)/FT (205–417 К), где А = 62,402508, В = -4343,5240, С = -7,8661534, D = = 1,0666308∙10−2, E = 95,248723, F = 424,90; при 20 °C давление пара Cl2 0,669 МПа; 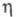 4,88∙10−4 Па x с, уравнение температурной зависимости
4,88∙10−4 Па x с, уравнение температурной зависимости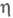 = [0,00585(1 + 0,05878t — 0,05392t2)]∙10−5 Па x с (от −34 до −77 °C);
= [0,00585(1 + 0,05878t — 0,05392t2)]∙10−5 Па x с (от −34 до −77 °C); 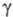 x 10−5 Н/см 31,61 ( −61,3 °C), 28,38 ( −44,5 °C), 25,23 ( −28,7 °C), уравнение температурной зависимости
x 10−5 Н/см 31,61 ( −61,3 °C), 28,38 ( −44,5 °C), 25,23 ( −28,7 °C), уравнение температурной зависимости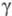 = [21,70(1 — 0,007742t)]∙10−5 Н/см;
= [21,70(1 — 0,007742t)]∙10−5 Н/см; 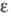 1,00152 (25 °C), 2,147 ( −65,15 °C), 2,088 ( −45,25 °C), 2,051 ( −22,0 °C), 1,968 (0 °C), 1,54 (142 °C). Электродный потенциал Cl2 (газ, 0,1 МПа)/С1− (в воде коэф. активности ~ 1) 1,3583 В; изотермич. коэф. сжимаемости жидкого Х. в интервале 0–10 МПа 0,0118%/МПа, адиабатич. коэф. сжимаемости газообразного Х. 5,73∙10−5%/ мм рт. ст.; температурный коэф. объемного расширения 21,9 x10−4 К−1 (298К); теплопроводность 0,079 Вт/(мx К) при 273 К. Кристаллизуется при −160 °C в ромбич. решетке, а = 0,624 нм, b = 0,448 нм, с = 0,826 нм, z = 4, пространственная группа Cmca, r = 0,1980 нм.
1,00152 (25 °C), 2,147 ( −65,15 °C), 2,088 ( −45,25 °C), 2,051 ( −22,0 °C), 1,968 (0 °C), 1,54 (142 °C). Электродный потенциал Cl2 (газ, 0,1 МПа)/С1− (в воде коэф. активности ~ 1) 1,3583 В; изотермич. коэф. сжимаемости жидкого Х. в интервале 0–10 МПа 0,0118%/МПа, адиабатич. коэф. сжимаемости газообразного Х. 5,73∙10−5%/ мм рт. ст.; температурный коэф. объемного расширения 21,9 x10−4 К−1 (298К); теплопроводность 0,079 Вт/(мx К) при 273 К. Кристаллизуется при −160 °C в ромбич. решетке, а = 0,624 нм, b = 0,448 нм, с = 0,826 нм, z = 4, пространственная группа Cmca, r = 0,1980 нм.
Х. хорошо раств. в неполярных жидкостях, хуже — в воде. Растворимость, % по массе: в CCl4 — 16,4 (0 °C), 8,46 (25 °C), бензоле — 24,7 (10 °C), 18,5 (20 °C), 14,7 (30 °C), воде — 1,44 (0 °C), 1,07 (6 °C), 0,828 (15 °C), 0,711 (20 °C), 0,626 (25 °C), 0,449 (40 °C), 0,323 (60 °C). В конц. растворах NaCl растворимость Cl2 в неск. раз ниже, чем в воде. В водном растворе Х. устанавливается равновесие:
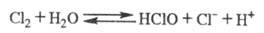
Из водного раствора кристаллизуется клатрат Cl2 x 6H2O, давление его диссоциации 0,1 МПа при 9,6 °C. С ионом СГ молекулы Cl2 образуют в водном растворе ионы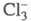 по реакции:
по реакции: 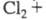 +
+ K = 0,19. Жидкий Х. сам может служить растворителем, напр. растворимость в Cl2, % по массе: ВCl3 65,5 ( −136,4 °C), SiCl4 28,8 (0 °C), TlCl4 74,9 (20 °C).
K = 0,19. Жидкий Х. сам может служить растворителем, напр. растворимость в Cl2, % по массе: ВCl3 65,5 ( −136,4 °C), SiCl4 28,8 (0 °C), TlCl4 74,9 (20 °C).
Х. — один из наиб. химически активных элементов, он непосредственно взаимод. со всеми металлами и большинством неметаллов (образуя хлориды), лишь реакция X. с O2, N2 и Xe требует спец. методов активации — УФ облучения или электроразряда, в остальных случаях достаточно простого нагревания. Хлорирование наиб. пассивных к Х. металлов начинается при след. температурах, °C: Ni 680, Mg 600, Pt 560, W 540, Cr 520, Mo 420, Та 380, Ag 260, Ti 250, Cu и А1 240, Fe 215. Сера и фтор реагируют с Х. при комнатной температуре, Si — при 200 °C, углерод в виде графита устойчив к Х. до 700 °C. Реакционная способность оксидов металлов по отношению к Х. (образуются хлориды) значительно ниже, чем у соответствующих металлов, и убывает в ряду: Na2O, Ag2O, CaO, PbO, CdO, MnO, NiO, ZnO, FeO, MgO, Fe2O3, ZnO2, TiO2, A12O3,
SiO2. В присут. углерода температура хлорирования оксидов снижается.
Причина высокой химической активности Х. — в сравнительной легкости образования атомов С1 из молекул Cl2, в высоком сродстве атома Х. к электрону (самое высокое среди атомов хим. элементов; выше, чем у фтора) и в высокой энергии связи Х. с большинством элементов. Стабильные соед. Х. — хлориды, гипохлориты, хлориты, хлораты, перхлораты. Действит. заряд на атоме С1 во всех соед. этих классов по абс. величине значительно ниже формального. Из-за высокого сродства атома С1 и хлоркислородных радикалов к электрону Х. бывает анионом, входит в состав аниона ( ,
, 
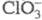 ,
,  ) или является лигандом в комплексных анионах
) или является лигандом в комплексных анионах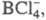
 и т.п.
и т.п.
Сильно экзотермич. реакция X. с H2 (Cl2 + H2 2HCl) приводит к образованию хлористого водорода (см. соляная кислота), она может протекать взрывообразно, особенно на свету: КПВ для системы H2 — Cl2 11,5 — 95% по объему Х. В присут. AlCl3 реакция гладко протекает в темноте при 130 °C.
2HCl) приводит к образованию хлористого водорода (см. соляная кислота), она может протекать взрывообразно, особенно на свету: КПВ для системы H2 — Cl2 11,5 — 95% по объему Х. В присут. AlCl3 реакция гладко протекает в темноте при 130 °C.
Прямое взаимод. X. с N2 возможно только в электроразряде, единств. известный бинарный хлорид азота NC13 чрезвычайно взрывчат, получают его хлорированием NH3 или солей аммония (см. азот). С кислородом Х. образует неск. хлора оксидов, наиб. важны Cl2O, ClO2, Cl2O6 и Cl2O7. Все оксиды Х. нестабильны и взрывоопасны. С фтором Х. образует 3 бинарных фторида: C1F, C1F3 и C1F5, все они м. б. получены прямой реакцией между элементами. Попытка выделить высш. фторид Х. не привела к успеху, однако известны его производные, напр. кристаллич.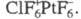 Прямой реакцией Cl2 с др. галогенами м. б. получены ICl, ICl3 и BrCl.
Прямой реакцией Cl2 с др. галогенами м. б. получены ICl, ICl3 и BrCl.
• см. также галогенфториды, межгалогенные соединения. О взаимод. Х. с орг. веществами см. галогенирование.
Получение. Практически весь производимый в мире Х. получают электрохим. методом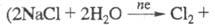
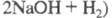 — электролизом водного раствора NaCl или, гораздо реже, KCl. Другие продукты электролиза — щелочь (1,13 т NaOH на 1 т Cl2) и H2. На получение 1 т Х. расходуют в зависимости от способа производства от 2300 до 3700 кВт x ч электроэнергии, что составляет примерно 50% издержек производства (в ценах на электроэнергию 1975), причем эта доля имеет тенденцию к росту. На производство Х. в США затрачивают ~2% всей вырабатываемой электроэнергии и 28% энергии, потребляемой в электрохим. промышленности.
— электролизом водного раствора NaCl или, гораздо реже, KCl. Другие продукты электролиза — щелочь (1,13 т NaOH на 1 т Cl2) и H2. На получение 1 т Х. расходуют в зависимости от способа производства от 2300 до 3700 кВт x ч электроэнергии, что составляет примерно 50% издержек производства (в ценах на электроэнергию 1975), причем эта доля имеет тенденцию к росту. На производство Х. в США затрачивают ~2% всей вырабатываемой электроэнергии и 28% энергии, потребляемой в электрохим. промышленности.
Используют 3 метода электролиза растворов хлоридов: 1) ртутный; катод — Hg, X. выделяется на твердом аноде и электродные пространства не разделены; 2) диафрагменный; оба электрода твердые, анодное и катодное пространство разделены фильтрующей диафрагмой; 3) мембранный; анодное и катодное пространства разделены катионообменной мембраной. Первые два метода существуют ок. 100 лет, третий применяют с 1975. При электролизе по второму методу непосредственно в электролизере образуется раствор NaOH и NaCl в молярном отношении 1:1. Упариванием этого "электролитич. щелока" получают товарный NaOH, содержащий 2–3,5% (в пересчете на NaOH) NaCl. Электролизом по первому способу получают амальгаму щелочного металла, при водном разложении которой образуются конц. растворы чистых щелочей NaOH или KOH. Возможность получения чистых щелочей, отвечающих требованиям, предъявляемым к реактивам, была осн. преимуществом ртутного метода до появления мембранного. Мембранный метод позволяет получать чистые щелочи без использования Hg, экологически менее опасен, требует меньшего расхода энергии и меньших капитальных вложений, поэтому доля X., полученного этим методом, непрерывно возрастает. Одновременно во всем мире падает доля ртутного метода. С 1986 Япония отказалась от ртутного метода.
До 60-х гг. в качестве материала для анодов в хлорном производстве использовался графит. Графитовые аноды подвергаются быстрому разрушению при электролизе, поэтому они заменены на металлические на основе Ti, Ti — Ru — Ir, Ti -Ir, Ti — Pt — Ir, покрытые активной массой из оксидов Ti и Ru. Оксиднорутениевые аноды обладают очень высокой коррозионной стойкостью (расход Ru ок. 0,1 г на 1 т Cl2) и обеспечивают хороший выход Х. по току даже при высокой степени превращения NaCl в анодном пространстве.
Фильтрующие диафрагмы изготовлялись из асбестовой бумаги или волокна, ныне используют асбест с полимерными связующими, что предупреждает набухание диафрагмы, либо полимерные диафрагмы из пористой перфторир. пленки или волокна. Эти диафрагмы имеют срок службы более 500 сут.
Мембраны, непроницаемые для жидкости и газа, пропускающие лишь ионы Na+ и К+, имеют толщину 0,1–0,25 мм и размеры 2 х 2 м, материал мембран — сополимеры тетрафторэтилена с сульфонилированными или карбоксилированными перфторвиниловыми эфирами. Срок службы мембран ок. 2 лет. В лаб. условиях Х. получают действием раствора HCl на пиролюзит MnO2.
Определение. Методы обнаружения и определения Х. основаны на его окислит. свойствах. Для обнаружения Х. в воздухе используют цветные реакции — иод-крахмальную, желтое окрашивание флуоресцеина в щелочной среде. Для определения Х. применяют иодометрич. метод, спектрофотометрич. методы — с о-толидином, с диметил- и диэтил-n-фенилендиаминами, с метиловым оранжевым и др. Потенциометрич. методы определения Х. основаны на количеств. переводе его либо в Cl−, либо в ClO− с послед. титрованием. В газовом потоке Х. может быть определен кулонометрически на газоанализаторе "Атмосфера-2". Атомно-абсорбционный, рентгеноспектральный и активационный метод используют в осн. для определения Х. в виде хлорида.
Применение. Х. расходуется на производство окислительно-отбеливающих веществ — кальция гипохлорита, натрия гипохлорита, LiClO, хлорной извести, а также хлоридов мн. элементов, разл. хлорорг. продуктов (поливинилхлорида, хлоропренового каучука, растворителей, продуктов хлорирования углеводородов парафинового и ароматич. рядов), разл. хлорсодержащих пестицидов, некоторых веществ, не содержащих хлор,- сульфанила, глицерина, этиленгликоля и т. п., для водоочистки. В мире на производство орг. продуктов расходуется от 50 до 85% производимого X., на производство неорг. продуктов — 10–15%, в целлюлозно-бумажной промышленности — 2–15%, на очистку воды и др. санитарные нужды — 2–10%.
Мировое производство Х. в 1991–92 составило 40–45 млн. т.
Х. весьма токсичен, во время 1-й мировой войны его использовали как боевое ОВ. Содержание Cl2 в воздухе 0,006 мг/л оказывает раздражающее действие на дыхат. пути, 0,012 мг/л переносится с трудом, концентрация выше 0,1 мг/л опасна для жизни: дыхание становится частым, судорожным, паузы продолжительными, остановка дыхания наступает через 5–25 мин. Вдыхание Х. более высокой концентрации может привести к мгновенной смерти в результате рефлекторного торможения дыхат. центра. ПДК в воздухе рабочей зоны 1,0 мг/м3, в атмосфере населенных пунктов разовая 0,1 мг/м3, среднесуточная 0,03 мг/м3.
Хранят Х. в стальных баллонах зеленого цвета.
Х. открыл К. Шееле в 1774, элементарную природу Х. установили в 1807–13 Г. Дэви, Ж. Гей-Люссак и Л. Тенар.
Лит.: Пасманик М. И., Сасс-Тисовский Б. А., Якименко Л. М., Производство хлора и каустической соды. Справочник, М., 1966; Фурман А. А., Неорганические хлориды. (Химия и технология), М., 1980; Фрумина Н. С, Лисенко Н. Ф., ЧерноваМ. А., Хлор, М., 1983.
В. Я. Росоловский
Значения в других словарях
- Хлор — (лат. Chlorum) Cl, химический элемент VII группы периодической системы Менделеева, атомный номер 17, атомная масса 35,453; относится к семейству галогенов (См. Галогены). Большая советская энциклопедия
- хлор — -а, м. Химический элемент, удушливый газ зеленовато-желтого цвета с резким запахом (используется в производстве для синтеза неорганических и органических продуктов, а также для обеззараживания воды, отбелки тканей и целлюлозы). [От греч. χλωρός — зеленый] Малый академический словарь
- хлор — орф. хлор, -а Орфографический словарь Лопатина
- хлор — Хлор/. Морфемно-орфографический словарь
- хлор — ХЛОР а, м. chlore m. | нем. Chlor н.-лат. chlorum <�гр. chloros зеленовато-желтый. Остро пахнущий, ядовитый, желто-зеленый газ, — отравляющее и обеззараживающее средство. Соединения хлора. БАС-1. Крысин 1998. Словарь галлицизмов русского языка
- хлор — ХЛОР (Chlorum) , Cl хим. элемент VII гр. периодич. системы Менделеева. Галоген, жёлто-зелёный газ с резким запахом. Встречается в природе только в виде соединений. Ср. содержание в земной коре 1,7-10-2% (по массе). Сельскохозяйственный словарь
- хлор — Заимств. в XIX в. из новолат. яз., где chlorum < греч. chlōros «желтовато-зеленый». Газ назван по своему цвету. Этимологический словарь Шанского
- ХЛОР — ХЛОР (символ С1), широко распространенный неметаллический элемент, один из ГАЛОГЕНОВ (элементы седьмой группы периодической таблицы), впервые открытый в 1774 г. Он входит в состав поваренной соли (NaCl). Научно-технический словарь
- Хлор — (Chlorum, Cl; от греч. chlōros зеленовато-желтый, бледно-зеленый) химический элемент подгруппы галогенов VII группы периодической системы элементов Д.И. Медицинская энциклопедия
- Хлор — Cl (лат. Chlorum; от греч. chloros — жёлто-зелёный * a. chlorine; н. Chlor; ф. chlore; и. cloro), — хим. элемент VII группы периодич. системы Mенделеева; относится к галогенам, ат. н. 17, ат. м. 35,453. Горная энциклопедия
- хлор — ХЛОР, а, м. Химический элемент, газ жёлто-зелёного цвета с резким запахом. | прил. хлористый, ая, ое и хлорный, ая, ое. Хлористый кальций. Хлористый аммоний. Хлорная известь (зернистый белый порошок, употр. в технике и санитарии). Толковый словарь Ожегова
- хлор — ХЛОР, хлора, мн. нет, ·муж. (от ·греч. chloros — зеленый) (·хим. ). Химический элемент, удушливый газ, употр. в технике, в санитарии как обеззараживающее и в военном деле как отравляющее вещество. Толковый словарь Ушакова
- хлор — ХЛОР -а; м. [от греч. chlōros — бледно-зелёный] Химический элемент (Cl), удушливый газ зеленовато-жёлтого цвета с резким запахом (используется как отравляющее и обеззараживающее средство). Соединения хлора. Отравление хлором. ◁ Хлорный (см.). Толковый словарь Кузнецова
- хлор — ХЛОР м. греч. одно из химических начал, основ, в поваренной соли. Хлоральгидрат получается при действии хлора на безводный спирт, кристаллизованное вешество; употр. как усыпляющее средство (Наумов). Хлоровый газ. Хлорные соли. Толковый словарь Даля
- хлор — Хлора, мн. нет, м. [от греч. chloros – зеленый] (хим.). Химический элемент, удушливый газ, употр. в технике, в санитарии как обеззараживающее и в военном деле как отравляющее вещество. Большой словарь иностранных слов
- ХЛОР — ХЛОР (лат. Chlorum) — Cl, химический элемент VII группы периодической системы Менделеева, атомный номер 17, атомная масса 35,453, относится к галогенам. Название от греч. chloros — желто-зеленый. Большой энциклопедический словарь
- хлор — хлор м. Химический элемент, удушливый газ зелёного цвета, употребляющийся в технике, санитарии и т.п. как отравляющее или обеззараживающее средство. Толковый словарь Ефремовой
